福建省莆田市2017-2018学年高考理综-化学二模考试试卷
试卷更新日期:2018-08-06 类型:高考模拟
一、单选题
-
1. 化学与社会、科学、技术、环境密切相关。下列说法错误的是( )A、T-碳是一种新型三维碳结构晶体,与C60互为同素异形体 B、推广利用CO2合成聚碳酸酯可降解塑料符合低碳经济理念 C、将金属钛、铝混合后在空气中熔化可制得强度较大的钛合金材料 D、为汽车安装尾气催化转化装置,可将尾气中的部分CO和NO转化为无毒气体2. NA代表阿伏加德罗常数的值。下列有关叙述正确的是( )A、常温常压下,1.8g甲基(—CD3)中含有的中子数为NA B、2.3g钠被O2完全氧化时,钠得到的电子数目为0.1NA C、9.2g甲苯被酸性KMnO4氧化生成苯甲酸时,反应中转移电子数为0.6NA D、常温下,1L pH=9的CH3COONa溶液中,发生电离的水分子数为1×10-9NA3. 四种常见有机物的比例模型如下图。下列说法正确的是( )
 A、乙可与溴水发生取代反应而使溴水褪色 B、甲能使酸性KMnO4溶液褪色 C、丙中的碳碳键是介于碳碳单键和碳碳双键之间的特殊的键 D、丁为醋酸分子的比例模型4. 短周期元素X、Y、Z、W在周期表中位置如图,其中W原子的次外层电子数是最内层电子数与最外层电子数的电子数之和。下列说法错误的是( )
A、乙可与溴水发生取代反应而使溴水褪色 B、甲能使酸性KMnO4溶液褪色 C、丙中的碳碳键是介于碳碳单键和碳碳双键之间的特殊的键 D、丁为醋酸分子的比例模型4. 短周期元素X、Y、Z、W在周期表中位置如图,其中W原子的次外层电子数是最内层电子数与最外层电子数的电子数之和。下列说法错误的是( )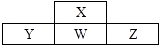 A、最简单的氢化物的沸点:X>W B、元素的非金属性:Z>W>Y C、简单离子的半径大小:Y>W>Z D、氧化物对应水化物的酸性:Y<W<Z5. 硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下。该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5。下列说法正确的是( )
A、最简单的氢化物的沸点:X>W B、元素的非金属性:Z>W>Y C、简单离子的半径大小:Y>W>Z D、氧化物对应水化物的酸性:Y<W<Z5. 硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下。该电池工作时的反应为4VB2+11O2=4B2O3+2V2O5。下列说法正确的是( )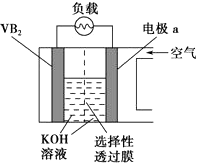 A、电极a为电池负极 B、反应过程中溶液的pH升高 C、电池连续反应过程中,选择性透过膜采用阳离子选择性膜 D、VB2极的电极反应式为:2VB2+ 22OH−-22e−=V2O5+ 2B2O3+ 11H2O6. 用下列实验装置进行相应实验,能达到实验目的的是( )
A、电极a为电池负极 B、反应过程中溶液的pH升高 C、电池连续反应过程中,选择性透过膜采用阳离子选择性膜 D、VB2极的电极反应式为:2VB2+ 22OH−-22e−=V2O5+ 2B2O3+ 11H2O6. 用下列实验装置进行相应实验,能达到实验目的的是( )
A、用装置甲进行中和热的测定 B、用装置乙制取CO2气体 C、用装置丙蒸发CH3COONa溶液得CH3COONa晶体 D、用装置丁模拟工业制氨气并检验产物7. 向10mL 1 mol·L-1的HCOOH溶液中不断滴加1 mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lg c水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法错误的是( ) A、常温下,Ka(HCOOH)的数量级为10-4 B、a、b两点pH均为7 C、从a点到b点,水的电离程度先增大后减小 D、混合溶液的导电性逐渐增强
A、常温下,Ka(HCOOH)的数量级为10-4 B、a、b两点pH均为7 C、从a点到b点,水的电离程度先增大后减小 D、混合溶液的导电性逐渐增强二、实验题
-
8. TiCl4是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4 , 设计实验如下(夹持装置略去):

已知:
①PdCl2溶液捕获CO时,生成金属单质和两种酸性气体化合物。
②TiCl4的制备需无水无氧且加热。
③
化合物
熔点/℃
沸点/℃
密度/g•cm-3
水溶性
TiCl4
-25
136.4
1.5
易水解生成难溶于水的物质,能溶于有机溶剂
CCl4
-23
76.8
1.6
难溶于水,与TiCl4互溶
请回答下列问题:
(1)、装置D中除生成TiCl4外,同时生成一种气态不成盐氧化物,该反应的化学方程式为。(2)、按照气流由左到右的方向,上述装置合理的连接顺序为a→→→f→g→→→→→(填仪器接口字母)。(3)、根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;(按符合题意的顺序填入下列操作的序号)。①加热装置D中陶瓷管 ②打开分液漏斗活塞
③停止加热,充分冷却 ④关闭分液漏斗活塞
实验时,当观察到时,开始进行步骤①。
(4)、设计实验证明装置E中收集到的液体中含有TiCl4:。(5)、装置F中发生反应的化学方程式为。(6)、制得的TiCl4产品中常含有少量CCl4 , 从产品中分离出TiCl4的操作名称为。三、综合题
-
9. K2SO4是无氯优质钾肥,Mn3O4是生产软磁铁氧体的原料,以硫酸工业的尾气为原料联合制备K2SO4和Mn3O4的工艺流程如图所示。回答下列问题:
 (1)、Mn3O4中的Mn元素有+2价和+3价两种情况,则 Mn3O4中+2价与+3价Mn 元素的物质的量之比为。(2)、“反应I”(填“是”或“不是”)氧化还原反应,为提高反应的反应速率,可采取的措施有(答出一条即可)。(3)、“反应II”的反应原理是。(4)、试剂a的电子式为。(5)、“一系列操作”指 , 该过程用到的非玻璃仪器为。(6)、流程图中“煅烧”操作的温度与剩余固体质量变化曲线如图所示。
(1)、Mn3O4中的Mn元素有+2价和+3价两种情况,则 Mn3O4中+2价与+3价Mn 元素的物质的量之比为。(2)、“反应I”(填“是”或“不是”)氧化还原反应,为提高反应的反应速率,可采取的措施有(答出一条即可)。(3)、“反应II”的反应原理是。(4)、试剂a的电子式为。(5)、“一系列操作”指 , 该过程用到的非玻璃仪器为。(6)、流程图中“煅烧”操作的温度与剩余固体质量变化曲线如图所示。
则产物A的化学式为 , 产物B的化学式为。
10. 苯乙烯是重要的基础有机化工原料。工业中以乙苯(C6H5-CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5-CH=CH2)的反应方程式: △H(1)、已知:
△H(1)、已知:化学键
C-H
C-C
C=C
H-H
键能/kJ·molˉ1
412
348
612
436
计算上述反应的△H= kJ·mol-1。
(2)、一定条件下,在体积不变的密闭容器中,反应过程中各物质浓度随时间变化的关系如下图所示。在t1时刻加入H2 , t2时刻再次达到平衡。物质X为 , 判断理由是。 (3)、在体积为2L的恒温密闭容器中通入2mol乙苯蒸汽,2分钟后达到平衡,测得氢气的浓度是0.5mol/L,则乙苯蒸汽的反应速率为;维持温度和容器体积不变,向上述平衡中再通入1mol氢气和1mol乙苯蒸汽,则v正v逆(填“大于”、“小于”或“等于”)。(4)、实际生产时反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用如图表示。[M=n(H2O)/n(乙苯)]
(3)、在体积为2L的恒温密闭容器中通入2mol乙苯蒸汽,2分钟后达到平衡,测得氢气的浓度是0.5mol/L,则乙苯蒸汽的反应速率为;维持温度和容器体积不变,向上述平衡中再通入1mol氢气和1mol乙苯蒸汽,则v正v逆(填“大于”、“小于”或“等于”)。(4)、实际生产时反应在常压下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比M对乙苯平衡转化率的影响可用如图表示。[M=n(H2O)/n(乙苯)]
① 比较图中A、B两点对应的平衡常数大小:KAKB
② 图中投料比(M1、M2、M3)的大小顺序为。
11. Al、Fe、Cu 是重要的材料元素,在生产生活中有着广泛的应用。回答下列问题:(1)、基态Fe2+的核外电子排布式为[Ar] , 有个未成对电子。(2)、氯化铝熔点为194℃,而氧化铝熔点为2050℃,二者熔点相差很大的原因是。(3)、已知Al的第一电离能为578kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。请解释其第二电离能增幅较大的原因。(4)、甲醇重整制氢反应中,铜基催化剂如CuO/SiO2具有重整温度低、催化选择性高的优点。Cu、Si、O元素电负性由大到小的顺序是;SiO2中Si原子采取杂化。(5)、一种铜的溴化物晶胞结构如图所示:该晶胞中铜的配位数是 , 与溴紧邻的溴原子数目是 , 由图中P点和Q点的原子坐标参数可确定R点的原子坐标参数为;已知晶胞参数为apm,其密度为g/cm3 (列出计算式即可)。 12. 有机物X是某种药物的主要成分,工业上合成该化合物的一种路线如下(部分反应物、反应条件略去):
12. 有机物X是某种药物的主要成分,工业上合成该化合物的一种路线如下(部分反应物、反应条件略去):
已知:酯与含羟基的化合物可发生如下酯交换反应:RCOO R′+R″OH RCOOR″+R′OH(R、R′、R″均代表烃基)。
(1)、反应①所需的试剂是 , 反应②的反应类型是。(2)、B中含氧官能团的名称是;反应④的产物除了X以外,另一种产物的名称是。(3)、D在一定条件下能发生缩聚反应生成高分子化合物,该高分子化合物的结构简式为。(4)、反应③的化学方程式为。(5)、E的同分异构体有多种,写出符合下列条件的有机物结构简式。Ⅰ.苯环上一氯代物只有一种
Ⅱ.与氯化铁溶液发生显色反应
Ⅲ.能与碳酸氢钠溶液反应放出CO2
(6)、已知:①
 ;②当苯环上已有一个“—CH3”或“—Cl”时,新引入的取代基一般在它的邻位或对位;当苯环上已有一个“—NO2”或“—COOH”时,新引入的取代基一般在它的间位。请写出以甲苯、乙醇为原料制备
;②当苯环上已有一个“—CH3”或“—Cl”时,新引入的取代基一般在它的邻位或对位;当苯环上已有一个“—NO2”或“—COOH”时,新引入的取代基一般在它的间位。请写出以甲苯、乙醇为原料制备  的合成路线图(无机试剂任用)。
的合成路线图(无机试剂任用)。
-