福建省福州市2017-2018学年高考理综-化学5月模拟考试试卷
试卷更新日期:2018-08-06 类型:高考模拟
一、单选题
-
1. 中国古代记载文字的器物中,主要成分为蛋白质的是( )A、甲骨 B、竹简 C、丝帛 D、青铜器2. 传统医学治疗疟疾时将青蒿加水煮沸,但药效很差。改用乙醇控温60℃提取青蒿素,药效显著提高。屠呦呦用一种更适宜的物质从青蒿中提取青蒿素,这种提取物对疟原虫的抑制率达到了100%,这种适宜的物质是( )
A
B
C
D
物质
乙醚
四氯化碳
丙醇
煤油
沸点℃
34.5
76.5
97.4
180-310
A、A B、B C、C D、D3. 已知一组有机物的分子式通式,按某种规律排列成下表。项序
1
2
3
4
5
6
7
……
通式
C2H4
C2H4O
C2H4O2
C3H6
C3H6O
C3H6O2
C4H8
……
各项物质均存在数量不等的同分异构体。其中第12项的异构体中,属于酯类的有(不考虑立体异构)( )
A、10种 B、9种 C、8种 D、7种4. 实验室在500℃时,隔绝空气加热硫酸亚铁铵[(NH4)2Fe(SO4)2]至分解完全并确定分解产物成分的装置如图所示(已知分解的固体产物可能有FeO、Fe2O3和Fe3O4 , 气体产物可能有NH3、N2、H2O、SO3和SO2)。下列说法正确的是( )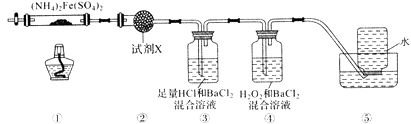 A、取①中固体残留物与稀硫酸反应并滴加KSCN,溶液变红,则残留物一定为Fe2O3 B、装置②用于检验分解产物中是否有水蒸气生成,试剂X最好选用碱石灰 C、装置③用于检验分解产物中是否有SO3气体生成并除去SO3和NH3 D、装置④用于检验分解产物中是否有SO2气体生成,装置⑤用于收集生成的NH3和N25. 一定条件下,在水溶液中1mol Cl-、ClOx- (x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( )
A、取①中固体残留物与稀硫酸反应并滴加KSCN,溶液变红,则残留物一定为Fe2O3 B、装置②用于检验分解产物中是否有水蒸气生成,试剂X最好选用碱石灰 C、装置③用于检验分解产物中是否有SO3气体生成并除去SO3和NH3 D、装置④用于检验分解产物中是否有SO2气体生成,装置⑤用于收集生成的NH3和N25. 一定条件下,在水溶液中1mol Cl-、ClOx- (x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( ) A、这些离子中结合H+能力最强的是E B、A,B,C,D,E五种微粒中C最稳定 C、C→B+D,反应物的总键能大于生成物的总键能 D、B→A+D反应的热化学方程式为:3ClO-(aq) = ClO3-(aq) + 2Cl-(aq) △H = -116kJ•mol-16. 某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液。下列说法正确的是( )A、电池工作时OH-向负极迁移 B、正极反应式为2FeO42-+10H++6e-=Fe2O3+5H2O C、该电池放电过程中电解质溶液浓度不变 D、电子由Zn电极流出,经KOH溶液流向正极7. 常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是( )
A、这些离子中结合H+能力最强的是E B、A,B,C,D,E五种微粒中C最稳定 C、C→B+D,反应物的总键能大于生成物的总键能 D、B→A+D反应的热化学方程式为:3ClO-(aq) = ClO3-(aq) + 2Cl-(aq) △H = -116kJ•mol-16. 某电池以K2FeO4和Zn为电极材料,KOH溶液为电解溶质溶液。下列说法正确的是( )A、电池工作时OH-向负极迁移 B、正极反应式为2FeO42-+10H++6e-=Fe2O3+5H2O C、该电池放电过程中电解质溶液浓度不变 D、电子由Zn电极流出,经KOH溶液流向正极7. 常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是( ) A、a点的pH=1 B、b点时,c (CH3COO-)=0.05mol/L C、c点时,V(NaOH)=20mL D、反应过程中 的值不断增大
A、a点的pH=1 B、b点时,c (CH3COO-)=0.05mol/L C、c点时,V(NaOH)=20mL D、反应过程中 的值不断增大二、综合题
-
8. 在有机化学中,硫酰氯(SO2Cl2)常用作氯化剂和氯磺化剂,在染料、药品、除草剂和农用杀虫剂的生产过程中有重要作用。现在拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =−97.3 kJ·mol−1 , 实验装置如图所示(部分夹持装置未画出)。
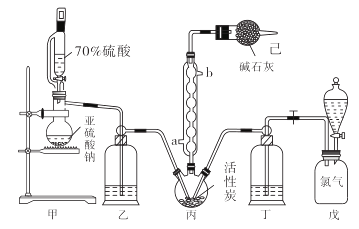
已知:硫酰氯通常条件下为无色液体,熔点−54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)、装置丙中作为反应容器的仪器的名称为 , 装置丙中球形冷凝管的作用是;如何控制两种反应物体积相等:。(2)、装置戊上方分液漏斗中最好选用下列试剂:_________________(选填字母)A、蒸馏水 B、饱和食盐水 C、浓氢氧化钠溶液 D、6.0 mol·L-1盐酸(3)、若缺少装置己,硫酰氯(SO2Cl2)会和空气中的水反应而变质,其化学方程式是。(4)、氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H SO2Cl2 + H2SO4 , 分离两种产物的方法是_____________(选填字母)。A、重结晶 B、过滤 C、蒸馏 D、萃取(5)、长期储存的硫酰氯会发黄,可能的原因是(用化学方程式和必要的文字加以解释)。(6)、若反应中消耗的氯气体积为896 mL(标准状况下),最后经过分离提纯得到4.05 g纯净的硫酰氯,则硫酰氯的产率为。(7)、请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):。9. 辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下所示: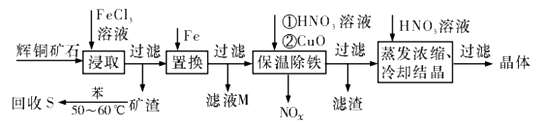 (1)、写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:(2)、“矿渣”中除了S以外,还有(填化学式);“回收S”过程中温度控制在50~60℃之间,不宜过高或过低的原因是(3)、“保温除铁”过程中,加入CuO的目的是;“蒸发浓缩、冷却结品”过程中,要用HNO3溶液调节溶液的pH,其理由是(4)、气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为;向“滤液M”中加入(或通入) (填母代号),可得到另一种流程中可循坏利用的物质。
(1)、写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:(2)、“矿渣”中除了S以外,还有(填化学式);“回收S”过程中温度控制在50~60℃之间,不宜过高或过低的原因是(3)、“保温除铁”过程中,加入CuO的目的是;“蒸发浓缩、冷却结品”过程中,要用HNO3溶液调节溶液的pH,其理由是(4)、气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为;向“滤液M”中加入(或通入) (填母代号),可得到另一种流程中可循坏利用的物质。a.铁
b.氯气
c.高锰酸钾
10. TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
资料:TiCl4及所含杂质氯化物的性质
化合物
SiCl4
TiCl4
AlCl3
FeCl3
MgCl2
沸点/℃
58
136
181(升华)
316
1412
熔点/℃
−69
−25
193
304
714
在TiCl4中的溶解性
互溶
——
微溶
难溶
(1)、氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行。已知:TiO2(s)+2 Cl2(g)= TiCl4(g)+ O2(g) ΔH1=+175.4 kJ·mol-1
2C(s)+O2(g)=2CO(g) ΔH2=-220.9 kJ·mol-1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式:。
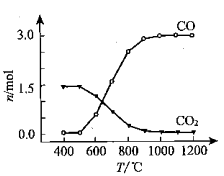
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的ΔH0(填“>”“<”或“=”),判断依据:。
③ 氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是。
④ 氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有。
(2)、精制过程:粗TiCl4经两步蒸馏得纯TiCl4。示意图如下: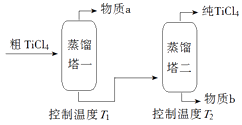
物质a是 , T2应控制在。
11. 元素周期表中,除了22种非金属元素外,其余的都是金属,请根据元素周期表回答下列问题:(1)、I.基态氮原子核外共有种运动状态不相同的电子,该原子核外电子排布中电子在能量最低的轨道呈形,用n表示能层,氟元素所在族的外围电子排布式为。(2)、在元素周期表中,某些主族元素与下方的主族元素的性质有些相似,被称为“对角线规则”,如下表: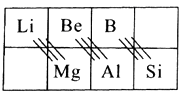
根据“对角线规则”写出Be(OH)2与NaOH反应的离子方程式 , 硼酸(H3BO3)是一种具有片层结构的白色晶体,层内的H3BO3分子间通过氢键相连(如图)。含1mol H3BO3的晶体中有mol氢键,H3BO3中B原子的杂化类型为。
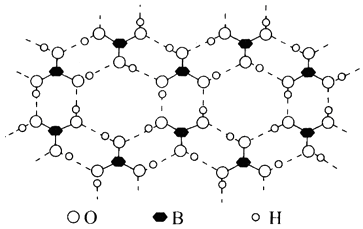 (3)、以第二周期为例,除Be、N外,其它元素的第一电离能从左到右逐渐增大的原因是。(4)、II.近年来铁及其化合物在工农业中有广阔的应用前景。
(3)、以第二周期为例,除Be、N外,其它元素的第一电离能从左到右逐渐增大的原因是。(4)、II.近年来铁及其化合物在工农业中有广阔的应用前景。铁的一种络离子[Fe(CN)6]4-中Fe2+的配位数为6,该络离子中不存在______(填序号)。
A、共价键 B、非极性键 C、配位键 D、δ键 E、π键(5)、AlCl3的熔点比NaCl熔点低的原因是。(6)、一种Al-Fe合金的立体晶胞如图所示。若晶体的密度为ρ g∙cm-3 , 则此合金中最近的两个Fe原子之间的距离为cm(用含ρ的代数式表示)。 12. 药物Targretin(F)能治疗顽固性皮肤T—细胞淋巴瘤,其合成路线如下图所示:
12. 药物Targretin(F)能治疗顽固性皮肤T—细胞淋巴瘤,其合成路线如下图所示: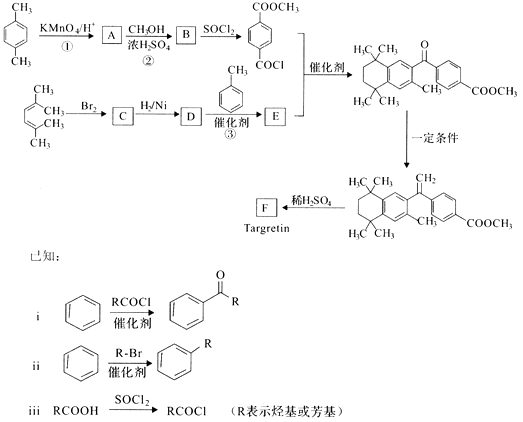 (1)、反应①的反应类型是。(2)、反应②的化学方程式:。(3)、C的核磁共振氢谱图中有个峰。(4)、反应③的化学方程式:。(5)、F的分子式是C24H28O2. F中含有的官能团:。(6)、写出满足下列条件A的两种同分异构体的结构简式(不考虑—O—O—或
(1)、反应①的反应类型是。(2)、反应②的化学方程式:。(3)、C的核磁共振氢谱图中有个峰。(4)、反应③的化学方程式:。(5)、F的分子式是C24H28O2. F中含有的官能团:。(6)、写出满足下列条件A的两种同分异构体的结构简式(不考虑—O—O—或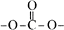 结构):。
结构):。a.苯环上的一氯代物有两种
b.既能发生银镜反应又能发生水解反应
(7)、已知: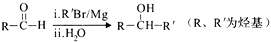 。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成
。以2-溴丙烷和乙烯为原料,选用必要的无机试剂合成 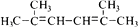 合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。