吉林省2018年初中毕业生学业水平考试化学试题
试卷更新日期:2018-08-06 类型:中考真卷
一、单选题
-
1. 物质的下列性质中,属于化学性质的是( )A、可燃性 B、状态 C、气味 D、硬度2. 空气是一种宝贵的资源,空气中体积分数最大的气体是( )A、稀有气体 B、二氧化碳 C、氧气 D、氮气3. 生活中可以使硬水软化成软水的常用方法是( )A、沉降 B、消毒 C、煮沸 D、过滤4. 下列实验操作正确的是( )A、
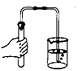 检查装置气密性
B、
检查装置气密性
B、 熄灭酒精灯
C、
熄灭酒精灯
C、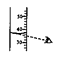 量取液体
D、
量取液体
D、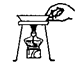 移走蒸发皿
5. 有关物质的用途,错误的是( )A、石墨做电极 B、干冰用于人工降雨 C、NH4Cl当做复合肥使用 D、小苏打用于焙制糕点6. 化学方程式_____+3CO 2Fe+3CO2中,所缺物质的化学式为( )A、FeO B、Fe2O3 C、Fe3O4 D、FeCO37. “保护好我们的环境”是每位公民应尽的义务。下列说法正确的是( )A、农药本身有毒,应该禁止施用农药 B、有害气体和烟尘会对空气造成污染 C、煤燃烧产生的二氧化碳会造成酸雨 D、工业废水不经处理就可以排放到江河里8. 关于电解水实验的下列说法中正确的是( )A、从现象上判断:正极产生的是氢气 B、从变化上分类:该变化属于物理变化 C、从宏观上分析:水是由氢气和氧气组成的 D、从微观上分析:水分子是由氢原子和氧原子构成的9. 下列实验设计能够实现其对应实验目的的是( )A、
移走蒸发皿
5. 有关物质的用途,错误的是( )A、石墨做电极 B、干冰用于人工降雨 C、NH4Cl当做复合肥使用 D、小苏打用于焙制糕点6. 化学方程式_____+3CO 2Fe+3CO2中,所缺物质的化学式为( )A、FeO B、Fe2O3 C、Fe3O4 D、FeCO37. “保护好我们的环境”是每位公民应尽的义务。下列说法正确的是( )A、农药本身有毒,应该禁止施用农药 B、有害气体和烟尘会对空气造成污染 C、煤燃烧产生的二氧化碳会造成酸雨 D、工业废水不经处理就可以排放到江河里8. 关于电解水实验的下列说法中正确的是( )A、从现象上判断:正极产生的是氢气 B、从变化上分类:该变化属于物理变化 C、从宏观上分析:水是由氢气和氧气组成的 D、从微观上分析:水分子是由氢原子和氧原子构成的9. 下列实验设计能够实现其对应实验目的的是( )A、 验证质量守恒定律
B、
验证质量守恒定律
B、 测定空气中氧气含量
C、
测定空气中氧气含量
C、 探究铁钉锈蚀的条件
D、
探究铁钉锈蚀的条件
D、 探究燃烧条件之一:温度达到着火点
10. 下列实验方案正确的是( )A、制备:用加热KCl和MnO2混合物的方法制O2 B、鉴别:用稀盐酸鉴别铁粉、木炭粉和氧化铜粉末 C、除杂:用溶解、蒸发的方法除去粗盐中的难溶性杂质 D、检验:用内壁涂有澄清石灰水的烧杯罩在甲烷燃烧的火焰上方,检验有水生成
探究燃烧条件之一:温度达到着火点
10. 下列实验方案正确的是( )A、制备:用加热KCl和MnO2混合物的方法制O2 B、鉴别:用稀盐酸鉴别铁粉、木炭粉和氧化铜粉末 C、除杂:用溶解、蒸发的方法除去粗盐中的难溶性杂质 D、检验:用内壁涂有澄清石灰水的烧杯罩在甲烷燃烧的火焰上方,检验有水生成二、填空题
-
11. 高纯硅是制造“芯片”的重要材料。根据右图回答下列问题。
 (1)、硅原子的相对原子质量是;(2)、硅原子的最外层电子数n=;(3)、沙子的主要成分是SiO2 , SiO2中硅元素的化合价为价。12. 请完成下列思维导图。
(1)、硅原子的相对原子质量是;(2)、硅原子的最外层电子数n=;(3)、沙子的主要成分是SiO2 , SiO2中硅元素的化合价为价。12. 请完成下列思维导图。
(1)(2)(3)(4)13. 某学校学生的午餐为米饭、炖牛肉、炒芹菜、油炸花生米等;餐具为竹制筷子、塑料饭盒。(1)、午餐中的牛肉富含的营养素是;(2)、用有机合成材料制成的餐具是 ;(3)、午餐后用洗涤剂清洗餐具上的油污,是利用了原理。三、简答题
-
14. 物质的变化常伴随能量变化。(1)、能量的变化常表现为温度的改变。稀释浓硫酸时,溶液的温度 ;(2)、氢气被认为是理想的清洁高能燃料。请写出氢气在氧气中燃烧的化学方程式。15. 根据右图中甲、乙两种固体物质的溶解度曲线回答问题。
 (1)、P点的含义:在t℃时甲与乙的溶解度;(2)、在温度不变的情况下,把乙的不饱和容液变为饱和溶液的方法是;(3)、甲中含有少量的乙,若提纯甲应采用的结晶方法是。16. 结合化学知识回答下列问题。(1)、试举一个能说明分子之间有间隔的例子:;(2)、CO2与CO的化学性质有很大不同的原因是。17. 用铝丝、洁净的铜丝、稀盐酸、AgNO3溶液,验证Al、Cu Ag的活动性顺序。(1)、把打磨过的铝丝和洁净的铜丝分别浸入稀盐酸中,观察到铝丝表面有气泡产生,铜丝表面无明显现象,由此判断出Al和Cu的活动性强弱顺序为>(H)>;发生反应的基本反应类型是 ;铝丝使用前需用砂纸打磨的原因是;(2)、为了达到实验目的,除(1)中实验外,还需要进行的实验是。
(1)、P点的含义:在t℃时甲与乙的溶解度;(2)、在温度不变的情况下,把乙的不饱和容液变为饱和溶液的方法是;(3)、甲中含有少量的乙,若提纯甲应采用的结晶方法是。16. 结合化学知识回答下列问题。(1)、试举一个能说明分子之间有间隔的例子:;(2)、CO2与CO的化学性质有很大不同的原因是。17. 用铝丝、洁净的铜丝、稀盐酸、AgNO3溶液,验证Al、Cu Ag的活动性顺序。(1)、把打磨过的铝丝和洁净的铜丝分别浸入稀盐酸中,观察到铝丝表面有气泡产生,铜丝表面无明显现象,由此判断出Al和Cu的活动性强弱顺序为>(H)>;发生反应的基本反应类型是 ;铝丝使用前需用砂纸打磨的原因是;(2)、为了达到实验目的,除(1)中实验外,还需要进行的实验是。四、实验题
-
18. 下图是实验室制取气体的常用装置。
 (1)、仪器①的名称是;(2)、选择恰当的装置,可用来加热高锰酸钾制取氧气,发生反应的化学方程式为;用E装置收集氧气时, 待集气瓶里的水排完后, , 再小心地把集气瓶移出水槽,正放在桌面上。(3)、实验室制取二氧化碳气体,应选择的发生装置和最佳收集装置是。
(1)、仪器①的名称是;(2)、选择恰当的装置,可用来加热高锰酸钾制取氧气,发生反应的化学方程式为;用E装置收集氧气时, 待集气瓶里的水排完后, , 再小心地把集气瓶移出水槽,正放在桌面上。(3)、实验室制取二氧化碳气体,应选择的发生装置和最佳收集装置是。五、科学探究题
-
19. 某化学兴趣小组的同学们在实验室里探究某些酸、碱、盐之间是否发生复分解反应。(1)、【查阅资料】硫酸钡(BaSO4)白色固体,不溶于水,也不溶于盐酸、硫酸和硝酸。
【实验与探究】
内容
现象
实验解析
结论
实验一

化学方程式是: K2CO3+H2SO4=K2SO4+H2O+CO2↑
生成物中有气体或有__或有沉淀生成时,复分解反应可以发生。
实验二

溶液颜色由红色恰好变为无色

实验三

产生白色沉淀
该反应的实质是: Ba2++SO42-=BaSO4↓
(2)、实验三结束后,某同学出于好奇,把实验三试管里的上层清液a倒入另一支洁净的试管中,向清液a中逐滴滴加K2CO3溶液。在滴加过程中,发现先产生气泡,然后又产生白色沉淀。根据上述现象,请你判断原清液a中的溶质是。(3)、【拓展与应用】 将稀盐酸Ca(OH)2溶液NaCl溶液Na2CO3溶液任意两种溶液相混合,写出能发生反应且有沉淀生成的化学方程式。六、计算题
-
20. 现有溶质质量分数为20%的NaOH溶液20g,与-定质量的稀盐酸恰好完全反应。
计算:
(1)、NaOH溶液中溶质的质量为多少g(2)、生成NaCl的质量多少。
-
-