2015-2016学年广东省阳江二中九年级上学期期末化学试卷(1-10单元)
试卷更新日期:2017-02-17 类型:期末考试
一、选择题
-
1. 下列过程中发生了化学变化的是( )A、用金刚石切割玻璃 B、用铅笔在纸上写字 C、用醋酸清洗热水瓶的水垢 D、用水将浓盐酸稀释2. 下列物质不能与氢氧化钠反应的是( )A、紫色石蕊试液 B、CuO C、CO2 D、H2SO43. 据报道,用于清洗龙虾的“洗虾粉”中含有柠檬酸钠、亚硫酸钠(Na2SO3)等物质,可能对人体的健康产生危害.Na2SO3中S元素的化合价为( )A、+6 B、+4 C、+2 D、﹣24. 下图所示的实验操作中,正确的是( )A、
 取用药品
B、
取用药品
B、 给试管加热
C、
给试管加热
C、 滴加液体
D、
滴加液体
D、 称量10.05g固体
5. 氢元素和氧元素的本质区别在于( )A、相对原子质量不同 B、核电荷数不同 C、元素符号不同 D、核外电子数不同6. 一些物质的近似pH为:泡菜3.4、苹果汁3.1、西瓜汁5.8、鸡蛋清7.6,其中酸性最强的是( )A、泡菜 B、苹果汁 C、西瓜汁 D、鸡蛋清7. 在一个密闭容器中放入M,N,Q,P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识不正确的是( )
称量10.05g固体
5. 氢元素和氧元素的本质区别在于( )A、相对原子质量不同 B、核电荷数不同 C、元素符号不同 D、核外电子数不同6. 一些物质的近似pH为:泡菜3.4、苹果汁3.1、西瓜汁5.8、鸡蛋清7.6,其中酸性最强的是( )A、泡菜 B、苹果汁 C、西瓜汁 D、鸡蛋清7. 在一个密闭容器中放入M,N,Q,P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如下表,则关于此反应认识不正确的是( )物质
M
N
Q
P
反应前质量(g)
18
1
2
32
反应后质量(g)
X
26
2
12
A、该变化的基本反应类型是分解反应 B、反应后物质M的质量为13g C、反应中N,P的质量比为5:4 D、物质Q可能是该反应的催化剂8. 白蚁能分泌出蚁酸.蚁酸的化学性质与盐酸相似,下列物质不与蚁酸反应的是( )A、Zn B、CO2 C、Fe2O3 D、Ca(OH)29. 图为A,B,C三种固体物质(不含结晶水)的溶解度曲线.下列说法错误的是( )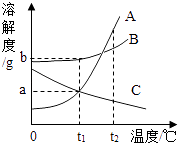 A、t1℃时,三种物质中B的溶解度最大 B、t2℃时,取三种物质各a g分别放入100g水中充分溶解,只有C物质能形成饱和溶液 C、将等质量的三种物质的饱和溶液分别由t2℃降温到t1℃,A溶液中析出的晶体质量最大 D、可用降温的方法使接近饱和的C溶液变为饱和溶液10. 向AgNO3和Cu( NO3)2混合溶液中加入一定量的锌粉,充分反应后,过滤,向固体加入稀盐酸,有气泡产生.下列说法正确的是( )A、一定无锌粉剩余 B、所得溶液中一定有Zn2+ , 一定没有Cu2+、Ag+ C、固体中一定有锌粉、银粉,可能有铜粉 D、所得溶液中一定有Zn2+ , 可能有Cu2+ , 没有Ag+11. 下列关于一氧化碳和二氧化碳的说法正确的是()A、都比空气重 B、都可以用碳和氧气反应得到 C、都有还原性 D、都能和澄清石灰水发生反应12. 金属X放入CuSO4溶液中有红色物质析出、放入ZnSO4溶液中无现象.则三种金属活动性由强到弱排列的是( )A、Zn、X、Cu B、Cu、X、Zn C、Zn、Cu、X D、X、Zn、Cu13. 如图是固体甲、乙的溶解度曲线图,下列说法正确的是( )
A、t1℃时,三种物质中B的溶解度最大 B、t2℃时,取三种物质各a g分别放入100g水中充分溶解,只有C物质能形成饱和溶液 C、将等质量的三种物质的饱和溶液分别由t2℃降温到t1℃,A溶液中析出的晶体质量最大 D、可用降温的方法使接近饱和的C溶液变为饱和溶液10. 向AgNO3和Cu( NO3)2混合溶液中加入一定量的锌粉,充分反应后,过滤,向固体加入稀盐酸,有气泡产生.下列说法正确的是( )A、一定无锌粉剩余 B、所得溶液中一定有Zn2+ , 一定没有Cu2+、Ag+ C、固体中一定有锌粉、银粉,可能有铜粉 D、所得溶液中一定有Zn2+ , 可能有Cu2+ , 没有Ag+11. 下列关于一氧化碳和二氧化碳的说法正确的是()A、都比空气重 B、都可以用碳和氧气反应得到 C、都有还原性 D、都能和澄清石灰水发生反应12. 金属X放入CuSO4溶液中有红色物质析出、放入ZnSO4溶液中无现象.则三种金属活动性由强到弱排列的是( )A、Zn、X、Cu B、Cu、X、Zn C、Zn、Cu、X D、X、Zn、Cu13. 如图是固体甲、乙的溶解度曲线图,下列说法正确的是( ) A、将甲、乙两物质的饱和溶液从20℃升到50℃,溶质质量分数大小为:甲>乙 B、甲、乙两物质的溶解度都随温度升高而减小 C、用降温结晶的方法可除去混在甲中的乙物质 D、20℃时,可配制质量分数为30%的乙物质溶液14. 学习金属单元后,我们知道Zn、Fe、Cu三种金属的活动性顺序为:Zn>Fe>Cu.为验证这一结论,下面实验设计合理的是( )A、将Zn、Cu两金属片分别放入稀盐酸中 B、将Fe、Cu两金属片分别放入稀盐酸中 C、将Zn、Fe两金属片分别放入CuCl2溶液中 D、将Zn、Cu两金属片分别放入FeCl2溶液中
A、将甲、乙两物质的饱和溶液从20℃升到50℃,溶质质量分数大小为:甲>乙 B、甲、乙两物质的溶解度都随温度升高而减小 C、用降温结晶的方法可除去混在甲中的乙物质 D、20℃时,可配制质量分数为30%的乙物质溶液14. 学习金属单元后,我们知道Zn、Fe、Cu三种金属的活动性顺序为:Zn>Fe>Cu.为验证这一结论,下面实验设计合理的是( )A、将Zn、Cu两金属片分别放入稀盐酸中 B、将Fe、Cu两金属片分别放入稀盐酸中 C、将Zn、Fe两金属片分别放入CuCl2溶液中 D、将Zn、Cu两金属片分别放入FeCl2溶液中二、填空题
-
15. 许多家庭做饭用罐装的“煤气”作燃料,罐中所装的是液化石油气,它是石油化工的一种产品.石油属于能源(填“可再生”或“不可再生”);若厨房失火时,要移走“煤气罐”,这是利用了原理灭火.
 16. 探究燃烧条件的实验装置如图所示
16. 探究燃烧条件的实验装置如图所示①由该实验得出,可燃物燃烧的条件是:、;
②实验中使用了铜片,主要是利用铜的性.
 17. 向盛有氢氧化钠溶液的锥形瓶里滴入几滴酚酞溶液,溶液变成色,pH7(填“>”、“<”或“=”),逐滴向锥形瓶中滴入盐酸并振荡,观察到的现象是 , 溶液的pH(填“增大”或“减小”).18. 有一瓶溶液pH是4.5,如果要使溶液的pH升高,可以用化学方法是 .19. 相同质量的M、N两种活泼金属,分别与足量的稀盐酸在室温下发生反应(M、N在生成物中的化合价为均为+2价),生成H2的质量m和反应时间t的关系如图所示.
17. 向盛有氢氧化钠溶液的锥形瓶里滴入几滴酚酞溶液,溶液变成色,pH7(填“>”、“<”或“=”),逐滴向锥形瓶中滴入盐酸并振荡,观察到的现象是 , 溶液的pH(填“增大”或“减小”).18. 有一瓶溶液pH是4.5,如果要使溶液的pH升高,可以用化学方法是 .19. 相同质量的M、N两种活泼金属,分别与足量的稀盐酸在室温下发生反应(M、N在生成物中的化合价为均为+2价),生成H2的质量m和反应时间t的关系如图所示.金属活动顺序是M比N(填“强”或“弱”);相对原的相对原子质量是M比N的(填“大”或“小”).
 20. 图为氯化铵和硫酸钠的溶解度曲线.请回答:
20. 图为氯化铵和硫酸钠的溶解度曲线.请回答: (1)、40℃时硫酸钠的溶解度为 g,此时它比氯化铵的溶解度(填:“大”或“小”),配制50g10%的硫酸钠溶液需要水 mL.(ρ水=1.0g/mL)(2)、将氯化铵和硫酸钠的饱和溶液从50℃降到20℃时,则这两种溶液中溶质的质量分数的关系是:氯化铵硫酸钠(填:“大于”或“小于”).21. 目前部分农村的饮用水主要还是地下水.饮用遭到污染或硬度大的地下水不利于人体健康.政府积极建设自来水厂,让农民喝上清洁的水.(1)、水垢[为CaCO3、Mg(OH)2]时,可用厨房酸性调料洗去;常用于净水作絮凝剂的是 .(2)、小红同学从某一欠收农田里取回一份土壤样品,如果检测结果呈酸性,从经济和可行方面考虑,那么要改良此土壤的酸性,应向农田里施加(填化学式).(3)、自来水生产过程中,可用方法除去水中不溶性杂质,同时还必须进行消毒.X是一种新型的自来水消毒剂,工业上制取X 的化学方程式为:Cl2+2NaClO2═2NaCl+2X,则X的化学式为 .22. 我市某电镀厂为减少水污染及节约成本,从含有CuSO4 , MgSO4、FeSO4的废水中回收重要原料MgSO4和有关金属,实验过程如图:
(1)、40℃时硫酸钠的溶解度为 g,此时它比氯化铵的溶解度(填:“大”或“小”),配制50g10%的硫酸钠溶液需要水 mL.(ρ水=1.0g/mL)(2)、将氯化铵和硫酸钠的饱和溶液从50℃降到20℃时,则这两种溶液中溶质的质量分数的关系是:氯化铵硫酸钠(填:“大于”或“小于”).21. 目前部分农村的饮用水主要还是地下水.饮用遭到污染或硬度大的地下水不利于人体健康.政府积极建设自来水厂,让农民喝上清洁的水.(1)、水垢[为CaCO3、Mg(OH)2]时,可用厨房酸性调料洗去;常用于净水作絮凝剂的是 .(2)、小红同学从某一欠收农田里取回一份土壤样品,如果检测结果呈酸性,从经济和可行方面考虑,那么要改良此土壤的酸性,应向农田里施加(填化学式).(3)、自来水生产过程中,可用方法除去水中不溶性杂质,同时还必须进行消毒.X是一种新型的自来水消毒剂,工业上制取X 的化学方程式为:Cl2+2NaClO2═2NaCl+2X,则X的化学式为 .22. 我市某电镀厂为减少水污染及节约成本,从含有CuSO4 , MgSO4、FeSO4的废水中回收重要原料MgSO4和有关金属,实验过程如图:
请回答:
(1)、滤液A和滤液B含有相同的溶质是 , 因此,可将滤液A和滤液B一起蒸发,其目的是 .(2)、写出步骤①中反应的化学方程式: , .(3)、步骤①加入的镁粉为什么要过量,请你简要说明理由 .(4)、固体B的物质是 .23. 现有下列物质,已知B为红色粉末,是赤铁矿的主要成分;D是用量最大的金属,E为无色气体,M为单质,无色溶液X在浓度高时具有挥发性. 各物质间可发生以下转化关系. (1)、若A为黑色粉末,则A的化学式是;
(1)、若A为黑色粉末,则A的化学式是;反应②的化学方程式是;
反应③的化学方程式是 .
(2)、若A为无色气体,则A的化学式是;此时,反应①的化学方程式是 .24. 请根据图1回答问题: (1)、仪器A的名称是 , 仪器B的名称是 .(2)、用KClO3与MnO2混合制取和收集纯净O2 , 应选用上图中的(填序号),反应的化学方程式 .(3)、实验室制取和收集CO2 , 应选用图中的(填序号),反应的化学方程式;如何检验已集满一瓶CO2气体 .(4)、若用图2进行CO还原Fe2O3的实验,往玻璃管通入CO前应先 , 反应时a处的现象为;该装置中气球的作用是 .25. 通过学习碱的性质,我校化学兴趣小组的同学对实验室的“氢氧化钙是否变质以及变化的程度”展开了探究活动,请你一同参与:(1)、提出问题:氢氧化钙是否变质?
(1)、仪器A的名称是 , 仪器B的名称是 .(2)、用KClO3与MnO2混合制取和收集纯净O2 , 应选用上图中的(填序号),反应的化学方程式 .(3)、实验室制取和收集CO2 , 应选用图中的(填序号),反应的化学方程式;如何检验已集满一瓶CO2气体 .(4)、若用图2进行CO还原Fe2O3的实验,往玻璃管通入CO前应先 , 反应时a处的现象为;该装置中气球的作用是 .25. 通过学习碱的性质,我校化学兴趣小组的同学对实验室的“氢氧化钙是否变质以及变化的程度”展开了探究活动,请你一同参与:(1)、提出问题:氢氧化钙是否变质?猜想与假设:同学们经过讨论认为样品存在三种可能情况:
①没有变质,为Ca(OH)2;②部分变质,为;③全部变质,为CaCO3 .
(2)、实验探究:实验步骤及操作
实验现象
实验结论
取样于试管中,加入足量蒸馏水振荡,静置
①取上层清液,滴入无色酚酞试液
②倒去上层清液,再向试管中的残渣注入稀盐酸
①无色酚酞试液变红
②
部分变质
①无色酚酞试液不变红
②
①
②没有气泡产生
(3)、小结与思考:小蔓同学根据上述实验方案进行实验,确定该样品已部分变质,氢氧化钙变质的原因是与空气中的反应所造成的;氢氧化钙容易变质,所以,必须保存.三、计算题
-
26. 媒体近日报道:市面上部分方便面遭到塑化剂污染,长期接触塑化剂可引起血液系统、生殖系统损害,其中,塑化剂(DMP)分子式为C10H10O4 . 求:(1)、DMP的相对分子质量为;(2)、DMP分子中C、H、O 三种元素的质量比为;(3)、97g塑化剂(DMP)中氧元素的质量为 g.27. 黄铜(由锌和铜形成的合金)有较强的耐磨性能,在生活中有广泛的用途.三位同学为了测定黄铜屑样品组成,分三次取样品与稀硫酸反应,其实验数据记录如表:
甲
乙
丙
样品质量/g
25
30
25
稀硫酸质量/g
120
80
80
充分反应后剩余物/g
144.8
109.8
104.8
请回答下列问题.
(1)、根据质量守恒定律,可算出甲、乙、丙三位同学均生成 g氢气,通过对这三位同学的实验数据进行两两对比,可得出同学所取的稀硫酸与黄铜最可能符合恰好完全反应;(2)、假如该同学所取的稀硫酸与黄铜恰好完全反应,请求出:①他所取的黄铜样品中锌的质量分数;
②所得溶液的溶质质量分数.(计算结果精确到0.1%)