2015-2016学年湖北省孝感市六校教学联盟高二上学期期末化学试卷
试卷更新日期:2017-02-17 类型:期末考试
一、选择题
-
1. “嫦娥奔月”是一个充满浪漫主义的中国神话故事.2007年10月24日我国“嫦娥一号”探月卫星由长三甲火箭送入预定的轨道.长三甲火箭第三级推进剂采用低温液氧/液氢.已知在298K时,2g氢气与氧气完全反应生成液态水放热285.8kJ,则此反应的热化学方程式为( )A、2H2(g)+O2(g)═2H2O(l)△H=﹣285.8KJ•mol﹣1 B、2H2(g)+O2(g)═2H2O(l)△H=+285.8KJ•mol﹣1 C、2H2(g)+O2(g)═2H2O(l)△H=﹣571.6KJ•mol﹣1 D、2H2(g)+O2(g)═2H2O(l)△H=+571.6KJ•mol﹣12. 获得“863”计划和中科院“百人计划”支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,相关论文发表在J.Am.Chem.Soc.(128,8720~8721,2006)上,已知电池总反应式为2Al+3I2═2AlI3 . 下列说法不正确的是( )A、该电池负极的电极反应为:Al﹣3e﹣═Al3+ B、该电池可能是一种可充电的二次电池 C、消耗相同质量金属时,用锂作负极产生电子的物质的量比用铝时多 D、电池工作时,溶液中铝离子向正极移动3. 有关化学反应的说法中,正确的是( )A、非自发反应在任何条件下都不能实现 B、自发反应都是熵增大的反应 C、能自发进行的吸热反应一定是熵增大的反应 D、自发反应都是放热反应4. 有关碰撞理论,下列说法中正确的是( )A、升温能使化学反应速率增大,主要原因是增加了反应物分子中活化分子的百分数 B、具有足够能量的分子(活化分子)相互碰撞就一定能发生化学反应 C、增大反应物浓度,可增大活化分子的百分数,从而使有效碰撞次数增大 D、催化剂不影响反应活化能,从而只影响反应速率不影响化学平衡5. 反应A(g)+3B(g)═2C(g)+2D(g),在不同情况下测得的反应速率如下,其中反应速率最大的是( )A、v(D)=0.4 mol•L﹣1•s﹣1 B、v(C)=0.5 mol•L﹣1•s﹣1 C、v(B)=0.6 mol•L﹣1•s﹣1 D、v(A)=0.15 mol•L﹣1•s﹣16. 下列物质中属于弱电解质的是( )A、氨水 B、盐酸 C、碳酸氢钠 D、冰醋酸7. 在25℃时,密闭容器中X,Y,Z三种气体的初始浓度和平衡浓度如下表:
物质
X
Y
Z
初始浓度/mol•L﹣1
0.1
0.2
0
平衡浓度/mol•L﹣1
0.05
0.05
0.1
下列说法错误的是( )
A、反应达到平衡时,X的转化率为50% B、反应可表示为X+3Y⇌2Z,其平衡常数为1600 C、增大压强使平衡向生成Z的方向移动,平衡常数增大 D、改变温度可以改变此反应的平衡常数8. 常温下,将0.1mol•L﹣1氢氧化钠溶液与0.06mol•L﹣1硫酸溶液等体积混合,该混合溶液的pH等于( )A、1.7 B、2.0 C、12.0 D、12.49. 在0.1mol•L﹣1 NH3•H2O溶液中存在如下电离平衡:NH3•H2O⇌NH4++OH﹣ . 对于该平衡,下列叙述中正确的是( )A、加入水时,溶液中 增大 B、降低温度,溶液中c(NH4+)增大 C、加入少量NaOH固体,平衡向左移动,电离平衡常数减小 D、加入少量0.1 mol•L﹣1 盐酸,溶液中c(OH﹣)增大10. 下列叙述正确的是( )A、95℃纯水的pH<7,说明加热可导致水呈酸性 B、pH=3的醋酸溶液稀释至10倍后pH=4 C、0.2 mol/L的盐酸与0.1 mol/L的盐酸等体积水混合后pH=1.5 D、pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH<711. 对于可逆反应:2A(g)+B(g)⇌2C(g)△H<0,下列各图中正确的是( )A、 B、
B、 C、
C、 D、
D、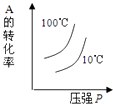 12. 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
12. 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( ) A、Ⅱ为盐酸稀释时的pH值变化曲线 B、b点溶液的导电性比c点溶液的导电性强 C、a点Kw的数值比c点Kw的数值大 D、b点酸的总浓度大于a点酸的总浓度13. 下列实验操作能达到目的是( )
A、Ⅱ为盐酸稀释时的pH值变化曲线 B、b点溶液的导电性比c点溶液的导电性强 C、a点Kw的数值比c点Kw的数值大 D、b点酸的总浓度大于a点酸的总浓度13. 下列实验操作能达到目的是( )①用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体
②用加热蒸发K2CO3溶液的方法获得K2CO3晶体
③用Na2S溶液和CuSO4溶液反应制取CuS固体
④加热MgCl2溶液制取MgCl2固体.
A、①② B、②③ C、③④ D、①③14. 已知Ksp(AgCl)=1.8×10﹣10 , Ksp(AgI)=1.0×10﹣16 . 下列说法错误的是( )A、AgCl不溶于水,不能转化为AgI B、在含有浓度均为0.001 mol•L﹣1的Cl﹣、I﹣的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀 C、AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI D、常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 ×10﹣11mol•L﹣115. 常温下,0.1mol•L﹣1某一元酸(HA)溶液的pH=3.下列叙述正确的是( )A、该溶液中:2c (H+)=c(A﹣)+c(OH﹣) B、由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,所得溶液中:c(Na+)>c(A﹣)>c(OH﹣)>c(H+) C、浓度均为0.1 mol•L﹣1的HA和NaA溶液等体积混合,所得溶液中:c(A﹣)>c(HA)>c(Na+)>c(OH﹣)>c(H+) D、0.1 mol•L﹣1 HA溶液与0.05 mol•L﹣1 NaOH溶液等体积混合,所得溶液中:2c(H+)+c(HA)═c(A﹣)+2c(OH﹣)16. 目前科学家已开发出一种新型燃料电池一固体氧化物电池,该电池用辛烷(C8H18)作燃料,电池中间部分的固体氧化物陶瓷可传递氧离子.下列说法正确的是( )A、电池工作时,氧气发生氧化反应 B、电池负极的电极反应为:O2+2H2O+4e﹣=4OH﹣ C、电池负极的电极反应为:C8H18+25O2﹣﹣50e﹣=8CO2+9H2O D、若消耗的O2为11.2 L(标准状况),则电池中有1 mol电子发生转移二、非选择题
-
17. 按要求填空(1)、已知H2的燃烧热:△H=﹣285.8kJ•mol﹣1 , C的燃烧热:△H=﹣393.5kJ•mol﹣1 , 若要得到1000kJ的热量,需完全燃烧 mol的H2生成液态水;2.5molC在O2中完全燃烧生成CO2 , 放出 kJ的热量,(保留到小数点后1位).(2)、0.05mol某液态有机物2.3g和一定量的氧气混合点燃,恰好完全燃烧,生成2.7g液态水和2.24CO2(标准状况)并放出68.35kJ热量,则能表达该有机物燃烧热的热化学方程式是 .18. 在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
时间(s)
C(mol/L)
0
20
40
60
80
100
C(N2O4)
0.20
a
0.10
c
d
e
C(NO2)
0.00
0.12
b
0.22
0.22
0.22
(1)、该反应的化学方程式为 , 表中bc(填“<”、“=”、“>”).(2)、20s时,N2O4的浓度为 mol/L,0~20s内N2O4的平均反应速率为 .(3)、该反应的平衡常数表达式K= , 在80℃时该反应的平衡常数K值为(保留2位小数).(4)、在其他条件相同时,该反应的K值越大,表明建立平衡时 .A、N2O4的转化率越高 B、NO2的产量越大 C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大.19. 实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH +6HCHO═3H++6H2O+(CH2)6N4H+[滴定时,1mol(CH2)6N4H+与1mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:步骤Ⅰ称取样品1.500g.
步骤Ⅱ将样品溶解后,完全转移到250mL容量瓶中,定容、充分摇匀.
步骤Ⅲ移取25.00mL样品溶液于250mL锥形瓶中,加入10mL 20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)、根据步骤Ⅲ填空:①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数(填“偏高”“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积(填“偏大”“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察 .
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由色变成色.
(2)、滴定结果如下表所示:滴定次数
待测溶液的体积/mL
标准溶液的体积/mL
滴定前刻度
滴定后刻度
1
25.00
1.02
21.03
2
25.00
2.00
21.99
3
25.00
0.20
20.20
若NaOH标准溶液的浓度为0.101 0mol•L﹣1 , 则该样品中氮的质量分数为(保留4位有效数字)
20. 如图所示的装置,C,D,E,F都是惰性 电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答以下问题: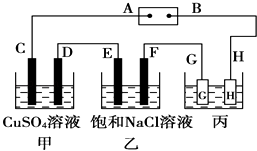 (1)、电极A是 . (填“正极”或“负极”)(2)、甲装置中电解反应的总化学方程式 .(3)、若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56mL(标准状况下)气体,电解后溶液体积为500mL时,求所得溶液在25℃时的pH= .(4)、欲用丙装置给铜镀银.G应该是(填“银”或“铜”),电镀液的主要成分是(填化学式)21. 有A,B,C,D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复).
(1)、电极A是 . (填“正极”或“负极”)(2)、甲装置中电解反应的总化学方程式 .(3)、若用惰性电极电解饱和NaCl溶液一段时间,当阳极产生56mL(标准状况下)气体,电解后溶液体积为500mL时,求所得溶液在25℃时的pH= .(4)、欲用丙装置给铜镀银.G应该是(填“银”或“铜”),电镀液的主要成分是(填化学式)21. 有A,B,C,D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复).阳离子
Na+、Ba2+、NH4+
阴离子
CH3COO﹣、OH﹣、Cl﹣、SO42﹣
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象.
(1)、A是 , B是(填化学式).(2)、用离子方程式表示A溶液pH大于7的原因: .(3)、写出C和D反应的离子方程式 .(4)、25℃时,0.1mol•L﹣1 B溶液的pH=a,则B溶液中c(H+)﹣c(NH3•H2O)=(用含有a的关系式表示).(5)、将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是 .