2015-2016学年河北省秦皇岛市卢龙县高二上学期期末化学试卷
试卷更新日期:2017-02-17 类型:期末考试
一、选择题
-
1. 下列说法正确的是( )A、所有的放热反应都能在常温常压下自发进行 B、Ba(OH)2•8H2O与NH4Cl反应属于放热反应 C、天然气燃烧时,其化学能全部转化为热能 D、反应热只与反应体系的始态和终态有关,而与反应的途径无关2. 下列反应条件的控制中,不恰当的是( )A、为了防止铁生锈,在其表面涂一层防锈油漆 B、为防止火灾,在面粉厂、加油站等场所要严禁烟火 C、为加快KClO3的分解速率,加入MnO2 D、为加快H2O2的分解速率,把反应容器放到冷水中冷却3. 下面关于水解应用的说法错误的是( )A、用热水溶解纯碱能够提高去油污的效果 B、配制氯化铁溶液时滴加几滴稀盐酸可以防止氢氧化铁形成 C、硫酸铵和草木灰混合施用到农田可以增强肥效 D、盐碱地(含NaCl、Na2CO3)施加适量石膏可以降低土壤的碱性4. 下列物质在常温下发生水解时,对应的水解方程式正确的是( )A、Na2CO3:CO32﹣+H2O⇌2OH﹣+CO2↑ B、NH4NO3:NH4++H2O⇌NH3•H2O+H+ C、CuSO4:Cu2++2H2O⇌Cu(OH)2↓+2H+ D、KF:F﹣+H2O═HF+OH﹣5. 下列说法不正确的是( )A、原电池外电路中电子由负极流向正极 B、原电池中发生还原反应的电极是正极 C、电解池中发生还原反应的电极是阳极 D、电解池中质量增加的电极是阴极6. 25℃时,水的电离达到平衡:H2O⇌H++OH﹣△H>0,下列叙述正确的是( )A、向水中加入氨水,平衡逆向移动,c(OH﹣)降低 B、向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 C、向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 D、将水加热,KW增大,pH不变7. 关于中和热测定实验的下列说法不正确的是( )
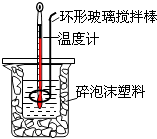 A、烧杯间填满碎泡沫塑料是减少实验过程中的热量损失 B、使用环形玻璃棒既可以搅拌又避免损坏温度计 C、向盛装酸的烧杯中加碱时要小心缓慢 D、测了酸后的温度计要用水清洗后再测碱的温度8. 根据热化学方程式(在101kPa时):S(s)+O2(g)=SO2(g)△H=﹣297.23kJ/mol 分析下列说法中不正确的是( )A、S的燃烧热为 297.2 kJ/mol B、S(g)+O2(g)=SO2(g)放出的热量大于297.2 kJ C、S(g)+O2(g)=SO2(g)放出的热量小于297.2 kJ D、形成1 mol SO 2中的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)中的化学键所吸收的总能量9. 2A(g)+B(g)⇌3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是( )A、V(A)=0.7mol.L﹣1 . min﹣1 B、V(B)=0.3mol.L﹣1 . min﹣1 C、V(C)=0.9mol.L﹣1 . min﹣1 D、V(D)=1.1mol.L﹣1 . min﹣110. 以Mg片和Al片为电极,并用导线连接,同时插入NaOH溶液中,下列说法正确的是( )A、Mg片作负极,电极反应:Mg﹣2e﹣═Mg2+ B、Al片作负极,电极反应:Al+4OH﹣﹣3e﹣═AlO2﹣+2H2O C、电子从Mg电极沿导线流向Al电极 D、Al片上有气泡产生11. 在盛有饱和碳酸钠溶液的烧杯中插入惰性电极,保持温度不变,通电一段时间后( )A、溶液的pH增大 B、Na+和CO32﹣的浓度减小 C、溶液的浓度增大 D、溶液的浓度不变,有晶体析出12. 下列化学实验事实及解释都正确的是( )A、向Na2SO3溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀出现,说明Na2SO3溶液已经变质 B、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 C、等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB D、向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明KSP[Cu(OH)2]>KSP[Mg(OH)2]13. 下列说法正确的是( )A、25℃时,pH=3的CH3COOH溶液加水稀释10倍后,pH=4 B、25℃时,pH=11的NaOH溶液加水稀释100倍后,pH=9 C、25℃时,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,pH=7 D、90℃时,纯水的pH=6.2,所以加热可以使水呈酸性14. 已知反应:①101kPa时,2C(s)+O 2(g)═2CO(g)△H=﹣221kJ•mol﹣1②稀溶液中,
A、烧杯间填满碎泡沫塑料是减少实验过程中的热量损失 B、使用环形玻璃棒既可以搅拌又避免损坏温度计 C、向盛装酸的烧杯中加碱时要小心缓慢 D、测了酸后的温度计要用水清洗后再测碱的温度8. 根据热化学方程式(在101kPa时):S(s)+O2(g)=SO2(g)△H=﹣297.23kJ/mol 分析下列说法中不正确的是( )A、S的燃烧热为 297.2 kJ/mol B、S(g)+O2(g)=SO2(g)放出的热量大于297.2 kJ C、S(g)+O2(g)=SO2(g)放出的热量小于297.2 kJ D、形成1 mol SO 2中的化学键所释放的总能量大于断裂1 mol S(s)和1 mol O2(g)中的化学键所吸收的总能量9. 2A(g)+B(g)⇌3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是( )A、V(A)=0.7mol.L﹣1 . min﹣1 B、V(B)=0.3mol.L﹣1 . min﹣1 C、V(C)=0.9mol.L﹣1 . min﹣1 D、V(D)=1.1mol.L﹣1 . min﹣110. 以Mg片和Al片为电极,并用导线连接,同时插入NaOH溶液中,下列说法正确的是( )A、Mg片作负极,电极反应:Mg﹣2e﹣═Mg2+ B、Al片作负极,电极反应:Al+4OH﹣﹣3e﹣═AlO2﹣+2H2O C、电子从Mg电极沿导线流向Al电极 D、Al片上有气泡产生11. 在盛有饱和碳酸钠溶液的烧杯中插入惰性电极,保持温度不变,通电一段时间后( )A、溶液的pH增大 B、Na+和CO32﹣的浓度减小 C、溶液的浓度增大 D、溶液的浓度不变,有晶体析出12. 下列化学实验事实及解释都正确的是( )A、向Na2SO3溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀出现,说明Na2SO3溶液已经变质 B、在海轮外壳上镶入锌块,可减缓船体的腐蚀速率 C、等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB D、向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明KSP[Cu(OH)2]>KSP[Mg(OH)2]13. 下列说法正确的是( )A、25℃时,pH=3的CH3COOH溶液加水稀释10倍后,pH=4 B、25℃时,pH=11的NaOH溶液加水稀释100倍后,pH=9 C、25℃时,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,pH=7 D、90℃时,纯水的pH=6.2,所以加热可以使水呈酸性14. 已知反应:①101kPa时,2C(s)+O 2(g)═2CO(g)△H=﹣221kJ•mol﹣1②稀溶液中,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ•mol﹣1下列结论正确的是( )
A、碳的燃烧热大于110.5 kJ•mol﹣1 B、①的反应热为221 kJ•mol﹣1 C、浓硫酸与稀NaOH溶液反应的成1 mol水,放出57.3 kJ热量 D、稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量15. 铅蓄电池是典型的可充电电池,在现代生活中有着广泛的应用,其充电、放电按下式进行:Pb+PbO2+2H2SO4 2PbSO4+2H2O,有关该电池的说法正确的( )A、放电时,电解质溶液的pH不断降低且正负极均有PbSO4 生成 B、放电时,每通过1mol电子,蓄电池就要消耗2mol H2SO4 C、充电时,阳极反应:PbSO4+2e﹣=Pb+SO42﹣ D、充电时,铅蓄电池的负极与外接电源的负极相连16. 设C+CO2⇌2CO;△H>0,反应速率为v1;N2+3H2⇌2NH3;△H<0,反应速率为v2 , 对于上述反应,当温度升高时,v1和v2的变化情况为( )A、同时增大 B、同时减小 C、v1增大,v2减小 D、v1减小,v2增大17. 从图中表示的各物质能量变化推断下列热化学方程式正确的是(a、b均为正数)( ) A、4P(白磷)+5O2(g)═2P2O5(S);△H1=+(a+b)kJ/mol B、4P(红磷)+5O2(g)═2P2O5(S);△H2=﹣(b)kJ/mol C、4P+5O2═2P2O5(s);△H3=+(a+b)kJ/mol D、P(白磷)═P(红磷);△H4=+(a)kJ/mol18. 25℃时,浓度为0.1mol/L的某一元强碱MOH溶液与相同体积的某一元酸HA溶液混合后恰好呈中性.下列判断一定正确的是( )A、HA酸溶液的pH值一定等于1 B、HA酸溶液的物质的量浓度一定等于0.1mol/L C、中和后溶液中M+离子浓度一定等于A﹣离子浓度 D、中和后生成的盐MA一定没有发生水解19. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、pH=1的溶液中:Fe2+、NO3﹣、SO42﹣、Na+ B、由水电离的c(H+)=1×10﹣14mol•L﹣1的溶液中:Ca2+、K+、Cl﹣、HCO3﹣ C、c(H+)/c(OH﹣)=1012的溶液中:NH4+、Al3+、NO3﹣、Cl﹣ D、c(Fe3+)=0.1mol•L﹣1的溶液中:K+、ClO﹣、SO42﹣、SCN﹣20. 用碱性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法中正确的是( )
A、4P(白磷)+5O2(g)═2P2O5(S);△H1=+(a+b)kJ/mol B、4P(红磷)+5O2(g)═2P2O5(S);△H2=﹣(b)kJ/mol C、4P+5O2═2P2O5(s);△H3=+(a+b)kJ/mol D、P(白磷)═P(红磷);△H4=+(a)kJ/mol18. 25℃时,浓度为0.1mol/L的某一元强碱MOH溶液与相同体积的某一元酸HA溶液混合后恰好呈中性.下列判断一定正确的是( )A、HA酸溶液的pH值一定等于1 B、HA酸溶液的物质的量浓度一定等于0.1mol/L C、中和后溶液中M+离子浓度一定等于A﹣离子浓度 D、中和后生成的盐MA一定没有发生水解19. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、pH=1的溶液中:Fe2+、NO3﹣、SO42﹣、Na+ B、由水电离的c(H+)=1×10﹣14mol•L﹣1的溶液中:Ca2+、K+、Cl﹣、HCO3﹣ C、c(H+)/c(OH﹣)=1012的溶液中:NH4+、Al3+、NO3﹣、Cl﹣ D、c(Fe3+)=0.1mol•L﹣1的溶液中:K+、ClO﹣、SO42﹣、SCN﹣20. 用碱性氢氧燃料电池为电源进行电解的实验装置示意图如图所示.下列说法中正确的是( ) A、燃料电池工作时负极反应为:H2=2H++2e﹣ B、若要实现铁上镀铜,则a极是铁,b极是铜 C、若要实现电解精炼粗铜,则a极发生氧化反应,b极上有铜析出 D、a、b两极均是石墨时,在相同条件下当电池中消耗H222.4L(标准状况)时,a极析出铜64g
A、燃料电池工作时负极反应为:H2=2H++2e﹣ B、若要实现铁上镀铜,则a极是铁,b极是铜 C、若要实现电解精炼粗铜,则a极发生氧化反应,b极上有铜析出 D、a、b两极均是石墨时,在相同条件下当电池中消耗H222.4L(标准状况)时,a极析出铜64g二、填空题
-
21. 向盛有10滴0.1mol/L AgNO3溶液的试管中滴加0.1mol/L NaCl溶液,至不再有白色沉淀生成,再向其中滴加0.1mol/L KI溶液,观察到;然后向其中滴加0.1mol/L Na2S溶液,又观察到 .22. 硫及其化合物在国民生产中占有重要的地位.(1)、常温常压下,已知1g 硫完全燃烧放出a kJ的热量,写出硫燃烧热的热化学方程式 .(2)、又已知2H2S(g)+O2(g)═2S(s)+2H2O(l)△H=﹣bkJ/mol,写出H2S完全燃烧生成二氧化硫和水的热化学方程式23. 课题式研究性学习是培养学生创造性思维的良好方法,某研究性学习小组将下列装置如图链接,C、D、E、F、X、Y都是惰性电极.将电源接通后,向乙中滴入酚酞试液,在F极附件先显红色.试回答下列问题:
 (1)、电源A极的名称是(2)、甲装置中电解反应的总化学方程式:(3)、如果收集乙装置中产生的气体,相同状况下两种气体的体积比是 .(4)、欲用丙装置给铜镀银,G应该是(填“铜”或“银”),电镀液的溶质是(填化学式).(5)、装置丁中的现象是 .24. 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2 , 引起了各国的普遍重视.(1)、目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,
(1)、电源A极的名称是(2)、甲装置中电解反应的总化学方程式:(3)、如果收集乙装置中产生的气体,相同状况下两种气体的体积比是 .(4)、欲用丙装置给铜镀银,G应该是(填“铜”或“银”),电镀液的溶质是(填化学式).(5)、装置丁中的现象是 .24. 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2 , 引起了各国的普遍重视.(1)、目前工业上有一种方法是用CO2来生产燃料甲醇.为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2 , 一定条件下发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=﹣49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示.

①从反应开始到平衡,氢气的平均反应速率 v (H2)=mol/(L•min).
②该反应的平衡常数表达式为 .
③下列措施中能使 n(CH3OH)/n(CO2)增大的是 .
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离 D.再充入1molCO2和3molH2
(2)、①在载人航天器的生态系统中,不仅要求分离去除CO2 , 还要求提供充足的O2 . 某种电化学装置可实现如下转化:2CO2═2CO+O2 , CO可用作燃料.已知该反应的阳极反应为:4OH﹣﹣4e﹣═O2↑+2H2O则阴极反应式为:
②有人提出,可以设计反应2CO═2C+O2(△H>0、△S<0)来消除CO的污染.请你判断是否可行并说出理由:;
25. 按要求填空(1)、常温下,0.1mol/L的醋酸和0.1mol/L的盐酸各100mL,分别与足量的锌粒反应,产生的气体体积前者后者(填“<”、“>”或“=”).(2)、将体积和物质的量浓度都相同的醋酸和氢氧化钠溶液混合后,溶液呈性(填“酸”,“中”或“碱”下同),溶液中 c(Na+) c(CH3COO﹣)(填“>”或“=”或“<”,下同 ).(3)、pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈性,溶液中c(Na+) c(CH3COO﹣)(4)、用Al2(SO4)3与NaHCO3溶液混合反应就是泡沫灭火器的工作原理,请写出反应的离子方程式 .26. 用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:(1)、准确称量8.6g含有少量中性易溶杂质的样品,配成500mL待测溶液.称量时,样品可放在 (填编号字母)称量.A、托盘上 B、洁净纸片上 C、小烧杯中(2)、滴定时,用0.2000mol•L﹣1的盐酸来滴定待测溶液,不可选用 (填编号字母)作指示剂.A、石蕊 B、甲基橙 C、酚酞(3)、滴定过程中,眼睛应注视;在铁架台上垫一张白纸,其目的是 .(4)、根据下表数据,计算被测烧碱溶液的物质的量浓度是 mol•L﹣1 , 烧碱样品的纯度是 .滴定次数
待测溶液
体积(mL)
标准酸体积
滴定前的刻度(mL)
滴定后的刻度(mL)
第一次
10
0.5
20.6
第二次
10
4.2
24.1
(5)、下列实验操作会对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?①滴定前酸式滴定管尖嘴处有气泡,滴定后充满溶液
②读取标准溶液体积时,滴定前仰视,滴定终点时平视 .