2015-2016学年福建省莆田二十四中高二下学期期末化学试卷
试卷更新日期:2017-02-17 类型:期末考试
一、选择题
-
1. 下列说法正确的是( )A、水解反应是吸热反应 B、升高温度可以抑制盐类的水解 C、正盐水溶液pH均为7 D、硫酸钠水溶液pH小于72. 1gH2燃烧生成液态水放出142.9KJ的热量,表示该反应的热化学方程式正确的是( )A、2H2(g)+O2(g)=2H2O(l)△H=﹣142.9kJ•mol﹣1 B、2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ•mol﹣1 C、2H2+O2=2H2O△H=﹣571.6kJ•mol﹣1 D、H2(g)+1/2O2(g)=H2O(g)△H=﹣285.8kJ•mol﹣13. 一定温度下,可逆反应A2(g)+3B2(g)⇌2AB3(g) 达到平衡的标志是( )A、容器内每减少1mol A2 , 同时生成2mol AB3 B、容器内每减少1mol A2 , 同时生成3mol B2 C、容器内A2、B2、AB3的物质的量之比为1:3:2 D、容器内A2、B2、AB3的物质的量浓度之比为1:1:14. 下列离子组中,能够在溶液中共存,加入NaOH溶液有沉淀生成,加入稀盐酸有气体放出的是 ( )A、Na+、Fe2+、Cl﹣、SO42﹣ B、Ba2+、K+、CO32﹣、Cl﹣ C、Al3+、Ca2+、Cl﹣、NO3﹣ D、Na+、Ba2+、NO3﹣、HCO3﹣5. 对于可逆反应:2A(g)+B(g)⇌2C(g)△H<0,下列各图中正确的是( )A、
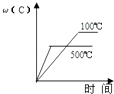 B、
B、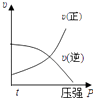 C、
C、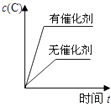 D、
D、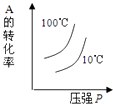 6. 下列各式中,属于正确的电离方程式的是( )A、HCO3﹣+H2O⇌H2CO3+OH﹣ B、HCO3﹣+OH﹣=H2O+CO32﹣ C、NH3+H+=NH4+ D、NH3•H2O⇌NH4++OH﹣7. 25℃时,pH=2的HCl溶液中,由水电离出的H+浓度是( )A、1×10﹣7mol•L﹣1 B、1×10﹣12mol•L﹣1 C、1×10﹣2mol•L﹣1 D、1×10﹣14mol•L﹣18. 镍镉(Ni﹣Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极材料是( )A、Cd(OH)2 B、Ni(OH)2 C、Cd D、NiO(OH)9. 用3g块状大理石与30mL 3mol/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是( )
6. 下列各式中,属于正确的电离方程式的是( )A、HCO3﹣+H2O⇌H2CO3+OH﹣ B、HCO3﹣+OH﹣=H2O+CO32﹣ C、NH3+H+=NH4+ D、NH3•H2O⇌NH4++OH﹣7. 25℃时,pH=2的HCl溶液中,由水电离出的H+浓度是( )A、1×10﹣7mol•L﹣1 B、1×10﹣12mol•L﹣1 C、1×10﹣2mol•L﹣1 D、1×10﹣14mol•L﹣18. 镍镉(Ni﹣Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O由此可知,该电池放电时的负极材料是( )A、Cd(OH)2 B、Ni(OH)2 C、Cd D、NiO(OH)9. 用3g块状大理石与30mL 3mol/L盐酸反应制取CO2气体,若要增大反应速率,可采取的措施是( )①再加入30mL 3mol/L盐酸 ②改用30mL 6mol/L盐酸 ③改用3g粉末状大理石 ④适当升高温度.
A、①②④ B、②③④ C、①③④ D、①②③10. 反应:A(气)+3B(气)⇌2C(气)△H<0达平衡后,将气体混合物的温度降低.下列叙述中正确的是( )A、正反应速率加大,逆反应速率变小,平衡向正反应方向移动 B、正反应速率变小,逆反应速率加大,平衡向逆反应方向移动 C、正反应速率和逆反应速率变小,平衡向正反应方向移动 D、正反应速率和逆反应速率变小,平衡向逆反应方向移动11. 能够使醋酸溶液的c(H+)减小和醋酸的电离平衡逆向移动的条件是( )A、滴加少量H2SO4溶液 B、加入少许水稀释 C、滴加少量NaOH溶液 D、加入少许CH3COONa晶体12. 下列有关叙述中正确的是( )A、难溶于水的电解质一定是弱电解质 B、强电解质的水溶液导电能力一定比弱电解质水溶液的导电能力强 C、易溶于水的电解质一定是强电解质 D、强电解质在水溶液中的电离过程是不可逆的13. 为了除去MgCl2酸性溶液中的Fe3+ , 可在加热搅拌的条件下加入一种试剂过滤后,再加入适量的盐酸,这种试剂是( )A、NH3•H2O B、NaOH C、Na2CO3 D、MgCO314. 25℃时,浓度均为0.2mol/L的NaHCO3和Na2CO3溶液中,下列判断不正确的是( )A、均存在电离平衡和水解平衡 B、存在的粒子种类相同 C、c(OH﹣)前者大于后者 D、分别加入NaOH固体,恢复到原温度,c(CO32﹣)均增大15. 室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10﹣9 mol2/L2 , 下列说法不正确的是( ) A、x数值为2×10﹣5 B、c点时有碳酸钙沉淀生成 C、加入蒸馏水可使溶液由d点变到a点 D、b点与d点对应的溶度积相等16. 关于各图的说法(其中①③④中均为惰性电极)正确的是( )A、
A、x数值为2×10﹣5 B、c点时有碳酸钙沉淀生成 C、加入蒸馏水可使溶液由d点变到a点 D、b点与d点对应的溶度积相等16. 关于各图的说法(其中①③④中均为惰性电极)正确的是( )A、 装置中阴极产生的气体能够使湿润淀粉KI试纸变蓝
B、
装置中阴极产生的气体能够使湿润淀粉KI试纸变蓝
B、 装置中待镀铁制品应与电源正极相连
C、
装置中待镀铁制品应与电源正极相连
C、 装置中电子由b极流向a极
D、
装置中电子由b极流向a极
D、 装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
装置中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
二、填空题
-
17. 二氧化硫和氮的氧化物是大气的主要污染物,防止和治理其对环境的污染是当前环保工作的重要研究内容之一.(1)、一定条件下,发生反应2SO2(g)+O2(g)⇌2SO3(g),向2L密闭容器中通入2mol SO2(g)、1mol O2(g)和0.2mol SO3(g),2min后反应达到平衡时,测得SO2的物质的量为1mol,则该可逆反应的平衡常数K=;恒温下,若往容器中再加入2mol SO2(g),则重新达到平衡时SO2的总转化率 0%(填“>”、“<”或“=”).(2)、在一密闭容器中发生反应2NO2⇌2NO+O2△H>0,反应过程中NO2的浓度随时间变化的情况如图所示.

请回答:
①依曲线A,反应在前3min内氧气的平均反应速率为 .
②若曲线A、B分别表示的是该反应在某不同条件下的反应情况,则此条件可能是(填“浓度”、“压强”、“温度”或“催化剂”).
(3)、一定温度下,在密闭容器中N2O5可发生下列反应:①2N2O5(g)⇌4NO2(g)+O2(g)
②2NO2(g)⇌2NO(g)+O2(g)
若达平衡时,c(NO2)=0.4mol•L﹣1 , c(O2)=1.3mol•L﹣1 , 则反应②中NO2的转化率为 , N2O5(g)的起始浓度应不低于 mol•L﹣1 .
18. 电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱.25℃时,有关物质的电离平衡常数如表所示:化学式
HF
H2CO3
HClO
电离平衡常数(Ka)
7.2×10﹣4
K1=4.4×10﹣7
K2=4.7×10﹣11
3.0×10﹣8
(1)、将浓度为0.1mol•L﹣1 HF溶液加水稀释一倍(假设温度不变),下列各量增大的是 .A、c(H+) B、c(H+)•c(OH﹣) C、 D、(2)、25℃时,在20mL 0.1mol•L﹣1氢氟酸中加入V mL 0.1mol•L﹣1 NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是 . A、pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等 B、①点时pH=6,此时溶液中c(F﹣)﹣c(Na+)=9.9×10﹣7 mol•L﹣1 C、②点时,溶液中的c(F﹣)=c(Na+) D、③点时V=20mL,此时溶液中c(F﹣)<c(Na+)=0.1mol•L﹣1(3)、物质的量浓度均为0.1mol•L﹣1的下列四种溶液:①Na2CO3溶液;②NaHCO3溶液;③NaF溶液;④NaClO溶液.依据数据判断pH由大到小的顺序是 .(4)、Na2CO3溶液显碱性是因为CO32﹣水解的缘故,请设计简单的实验事实证明之 .(5)、长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H﹣O﹣F.HFO与水反应得到HF和化合物A,每生成1mol HF转移 mol电子.19. 电解原理在化学工业中有着广泛的应用.现将设计的原电池通过导线与下图中电解池相连,其中,a为电解质溶液,X和Y是两块电极板,则:
A、pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等 B、①点时pH=6,此时溶液中c(F﹣)﹣c(Na+)=9.9×10﹣7 mol•L﹣1 C、②点时,溶液中的c(F﹣)=c(Na+) D、③点时V=20mL,此时溶液中c(F﹣)<c(Na+)=0.1mol•L﹣1(3)、物质的量浓度均为0.1mol•L﹣1的下列四种溶液:①Na2CO3溶液;②NaHCO3溶液;③NaF溶液;④NaClO溶液.依据数据判断pH由大到小的顺序是 .(4)、Na2CO3溶液显碱性是因为CO32﹣水解的缘故,请设计简单的实验事实证明之 .(5)、长期以来,一直认为氟的含氧酸不存在.1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H﹣O﹣F.HFO与水反应得到HF和化合物A,每生成1mol HF转移 mol电子.19. 电解原理在化学工业中有着广泛的应用.现将设计的原电池通过导线与下图中电解池相连,其中,a为电解质溶液,X和Y是两块电极板,则: (1)、若X、Y均为惰性电极,a为饱和NaCl溶液,则电解时.检验Y电极反应产物的方法是(2)、若X和Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中生成的白色固体物质露置在空气中可观察到的现象为 .(3)、若要在一块铁片上均匀镀锌,则X为 , a为溶液.(4)、若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1mol Cu(OH)2 , 恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 .20. 取一定量饱和FeCl3溶液,进行如下实验:(1)、加入少量NaOH(s),FeCl3的水解程度(填“增强”“减弱”或“不变”).(2)、将溶液加热蒸干,并灼热,最后得到的固体是(写化学式).(3)、向FeCl3溶液中通入HCl(g),溶液的pH(填“增大”“减小”或“不变”),FeCl3的水解程度(填“增强”“减弱”或“不变”).(4)、向FeCl3溶液中滴加石蕊试液,现象是 .21. 用中和滴定的方法测定NaOH和Na2CO3混合溶液中NaOH的含量时,可先在混合溶液中加入过量的氯化钡溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂).试完成下列问题:(1)、向混有BaCO3沉淀的NaOH溶液中滴入盐酸,为什么不会使BaCO3溶解而能测定NaOH的含量? .(2)、滴定终点时溶液颜色如何变化? .(3)、滴定时,若滴定管中滴定液一直下降到活塞处才到达终点,能否据此得出准确的滴定结果(填“能”或“不能”).(4)、能否改用甲基橙作指示剂(填“能”或“不能”) , 如果用甲基橙作指示剂,则测定结果如何?(填“偏高”“偏低”或“正确”).
(1)、若X、Y均为惰性电极,a为饱和NaCl溶液,则电解时.检验Y电极反应产物的方法是(2)、若X和Y分别为石墨和铁,a仍为饱和的NaCl溶液,则电解过程中生成的白色固体物质露置在空气中可观察到的现象为 .(3)、若要在一块铁片上均匀镀锌,则X为 , a为溶液.(4)、若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1mol Cu(OH)2 , 恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为 .20. 取一定量饱和FeCl3溶液,进行如下实验:(1)、加入少量NaOH(s),FeCl3的水解程度(填“增强”“减弱”或“不变”).(2)、将溶液加热蒸干,并灼热,最后得到的固体是(写化学式).(3)、向FeCl3溶液中通入HCl(g),溶液的pH(填“增大”“减小”或“不变”),FeCl3的水解程度(填“增强”“减弱”或“不变”).(4)、向FeCl3溶液中滴加石蕊试液,现象是 .21. 用中和滴定的方法测定NaOH和Na2CO3混合溶液中NaOH的含量时,可先在混合溶液中加入过量的氯化钡溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂).试完成下列问题:(1)、向混有BaCO3沉淀的NaOH溶液中滴入盐酸,为什么不会使BaCO3溶解而能测定NaOH的含量? .(2)、滴定终点时溶液颜色如何变化? .(3)、滴定时,若滴定管中滴定液一直下降到活塞处才到达终点,能否据此得出准确的滴定结果(填“能”或“不能”).(4)、能否改用甲基橙作指示剂(填“能”或“不能”) , 如果用甲基橙作指示剂,则测定结果如何?(填“偏高”“偏低”或“正确”).