2017年高考化学备考复习专题十:电化学及其应用
试卷更新日期:2017-02-17 类型:二轮复习
一、单选题
-
1. 下列有关“化学与生活”的叙述不正确的是( )A、点燃爆竹后,硫燃烧生成SO3 B、中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 C、服用阿司匹林出现水杨酸反应时,用NaHCO3溶液解毒 D、使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱2. 某电动汽车配载一种可充放电的锂离子电池,放电时电池总反应为:Li1﹣xCoO2+LixC6═LiCoO2+C6(x<1),下列关于该电池的说法不正确的是( )A、放电时,Li+在电解质中由负极向正极迁移 B、放电时,负极的电极反应式为LixC6﹣xe﹣═xLi++C6 C、充电时,若转移1mol e﹣ , 石墨(C6)电极将增重7x g D、充电时,阳极的电极反应式为LiCoO2﹣xe﹣═Li1﹣xCoO2+xLi+3.
用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是()
 A、用石墨作阳极,铁作阴极 B、阳极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O C、阴极的电极反应式为:2H2O+2e-=H2↑+2OH- D、除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O4.
A、用石墨作阳极,铁作阴极 B、阳极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O C、阴极的电极反应式为:2H2O+2e-=H2↑+2OH- D、除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O4.在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
 A、X是电源的负极 B、阴极的反应式是:H2O+2eˉ=H2+O2-CO2+2eˉ=CO+O2- C、总反应可表示为:H2O+CO2
A、X是电源的负极 B、阴极的反应式是:H2O+2eˉ=H2+O2-CO2+2eˉ=CO+O2- C、总反应可表示为:H2O+CO2 H2+CO+O2
D、阴、阳两极生成的气体的物质的量之比是1︰1
5. 锌﹣空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH﹣+2H2O═2Zn(OH)42﹣ . 下列说法正确的是( )A、充电时,电解质溶液中K+向阳极移动 B、充电时,电解质溶液中c(OH﹣)逐渐减小 C、放电时,负极反应为:Zn+4OH﹣﹣2e﹣═Zn(OH)42﹣ D、放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)6.
H2+CO+O2
D、阴、阳两极生成的气体的物质的量之比是1︰1
5. 锌﹣空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH﹣+2H2O═2Zn(OH)42﹣ . 下列说法正确的是( )A、充电时,电解质溶液中K+向阳极移动 B、充电时,电解质溶液中c(OH﹣)逐渐减小 C、放电时,负极反应为:Zn+4OH﹣﹣2e﹣═Zn(OH)42﹣ D、放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)6.研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )
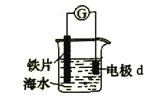 A、d为石墨,铁片腐蚀加快 B、d为石墨,石墨上电极反应为:O2 + 2H2O + 4e → 4OH– C、d为锌块,铁片不易被腐蚀 D、d为锌块,铁片上电极反应为:2H+ + 2e → H2↑7.
A、d为石墨,铁片腐蚀加快 B、d为石墨,石墨上电极反应为:O2 + 2H2O + 4e → 4OH– C、d为锌块,铁片不易被腐蚀 D、d为锌块,铁片上电极反应为:2H+ + 2e → H2↑7.用石墨电极完成下列电解实验.
实验一
实验二
装置

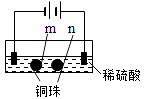
现象
a、d处试纸变蓝;b处变红,局部褪色;c处无明显变化
两个石墨电极附近有气泡产生;n处有气泡产生;…
下列对实验现象的解释或推测不合理的是( )
A、a、d处:2H2O+2e﹣═H2↑+2OH﹣ B、b处:2Cl﹣﹣2e﹣═Cl2↑ C、c处发生了反应:Fe﹣2e﹣═Fe2+ D、根据实验一的原理,实验二中m处能析出铜8.三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )
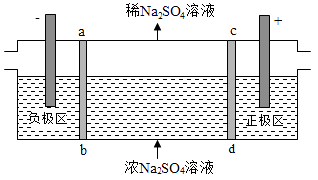 A、通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大 B、该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 C、负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低 D、当电路中通过1mol电子的电量时,会有0.5mol的O2生成9. 下列说法正确的是( )
A、通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大 B、该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 C、负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低 D、当电路中通过1mol电子的电量时,会有0.5mol的O2生成9. 下列说法正确的是( )
A、氢氧燃料电池工作时,H2在负极上失去电子 B、0.1mol•L﹣1Na2CO3溶液加热后,溶液的pH减小 C、常温常压下,22.4LCl2中含有的分子数为6.02×1023个 D、室温下,稀释0.1mol•L﹣1CH3COOH溶液,溶液的导电能力增强10.图1是铜锌原电池示意图.图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )
 A、铜棒的质量 B、c(Zn2+) C、c(H+) D、c(SO42﹣)11. 课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成.下列结论错误的是( )
A、铜棒的质量 B、c(Zn2+) C、c(H+) D、c(SO42﹣)11. 课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成.下列结论错误的是( ) A、原电池是将化学能转化成电能的装置 B、原电池由电极、电解质溶液和导线等组成 C、图中a极为铝条、b极为锌片时,导线中会产生电流 D、图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片12. 某同学为了使反应2HCl+2Ag═2AgCl+H2↑能进行,设计了下列四个实验,如图所示,你认为可行的方案是( )A、
A、原电池是将化学能转化成电能的装置 B、原电池由电极、电解质溶液和导线等组成 C、图中a极为铝条、b极为锌片时,导线中会产生电流 D、图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片12. 某同学为了使反应2HCl+2Ag═2AgCl+H2↑能进行,设计了下列四个实验,如图所示,你认为可行的方案是( )A、 B、
B、 C、
C、 D、
D、 13. MCFC型燃料电池可同时供应电和水蒸气,其工作温度为600¾﹣700¾,所用燃料为H2 , 电解质为熔融的K2CO3 . 已知该电池的总反应为2H2+O2═2H2O,则下列有关该电池的说法正确的是( )A、该电池的正极的反应式为:4OH﹣+4e﹣═O2+2H2O B、该电池负极的反应为:H2+CO32﹣﹣2e﹣═H2O+CO2 C、放电时CO32﹣向正极移动 D、该燃料电池能量转化率很低14. 电解NaCl溶液的装置如图所示,下列说法不正确的是( )
13. MCFC型燃料电池可同时供应电和水蒸气,其工作温度为600¾﹣700¾,所用燃料为H2 , 电解质为熔融的K2CO3 . 已知该电池的总反应为2H2+O2═2H2O,则下列有关该电池的说法正确的是( )A、该电池的正极的反应式为:4OH﹣+4e﹣═O2+2H2O B、该电池负极的反应为:H2+CO32﹣﹣2e﹣═H2O+CO2 C、放电时CO32﹣向正极移动 D、该燃料电池能量转化率很低14. 电解NaCl溶液的装置如图所示,下列说法不正确的是( ) A、铁电极上的电极反应式为Fe﹣2e﹣=Fe2+ B、溶液中Na+向铁电极方向移动 C、通电一段时间后,可看到铁电极附近溶液变红 D、通电一段时间后,可看到试管中溶液变蓝15. 关于铅蓄电池的说法正确的是( )A、在放电时,正极发生的反应是 Pb(s)+SO42﹣(aq)=PbSO4(s)+2e﹣ B、在放电时,该电池的负极材料是铅板 C、在充电时,电池中硫酸的浓度不断变小 D、在充电时,阳极发生的反应是 PbSO4(s)+2e﹣=Pb(s)+SO42﹣(aq)16.
A、铁电极上的电极反应式为Fe﹣2e﹣=Fe2+ B、溶液中Na+向铁电极方向移动 C、通电一段时间后,可看到铁电极附近溶液变红 D、通电一段时间后,可看到试管中溶液变蓝15. 关于铅蓄电池的说法正确的是( )A、在放电时,正极发生的反应是 Pb(s)+SO42﹣(aq)=PbSO4(s)+2e﹣ B、在放电时,该电池的负极材料是铅板 C、在充电时,电池中硫酸的浓度不断变小 D、在充电时,阳极发生的反应是 PbSO4(s)+2e﹣=Pb(s)+SO42﹣(aq)16.金属(M)﹣空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n , 已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( )
 A、采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面 B、比较Mg,Al,Zn三种金属﹣空气电池,Al﹣空气电池的理论比能量最高 C、M﹣空气电池放电过程的正极反应式:4M++nO2+2nH2O+4ne﹣=4M(OH)n D、在Mg﹣空气电池中,为防止负极区沉积Mg(OH)2 , 宜采用中性电解质及阳离子交换膜
A、采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面 B、比较Mg,Al,Zn三种金属﹣空气电池,Al﹣空气电池的理论比能量最高 C、M﹣空气电池放电过程的正极反应式:4M++nO2+2nH2O+4ne﹣=4M(OH)n D、在Mg﹣空气电池中,为防止负极区沉积Mg(OH)2 , 宜采用中性电解质及阳离子交换膜二、填空题
-
17. 下列反应:①氢氧化钠与硫酸,②一氧化碳与氧气,③八水合氢氧化钡与氯化铵,④金属铜与硝酸银.其中(用序号填空):能设计成原电池的反应是 .18. 材料是经济和生态文明建设的重要物质基础.
①生产硅酸盐水泥和普通玻璃都需用到的共同原料是 .
②橡胶是制造轮胎的重要原料,橡胶属于(填字母).
A.金属材料 B.无机非金属材料 C.有机高分子材料
③钢铁制品在潮湿的空气中能发生腐蚀.发生该腐蚀时的负极反应式为 .
19. 用铜片和铝片为电极,与电解质溶液构成原电池,回答相关问题(1)两极用导线连接同时插入稀硫酸中, 做负极,正极反应方程式为
(2)两极用导线连接同时插入浓硝酸中, 做负极,正极反应方程式为
20. 如图为以惰性电极进行电解:
写出A、B、电极上的电极反应式和总反应式:
A: ,
B: ,
总反应方程式: .
三、探究题
-
21. 每年世界上钢铁的产量很高,但钢铁腐蚀也给人类带来了巨大的损失,因此如何更好地进行金属防护,一直是科学研究领域中的重要课题。(1)、钢铁在潮湿的空气中的锈蚀主要属于 , 沿海地区的钢铁腐蚀比内陆地区更严重的原因是。(2)、据环保部门测定,我国一些大城市的酸雨pH=3.5。在酸雨季节铁制品极易腐蚀,则在其腐蚀中正极发生的反应是。(3)、在工业上常用亚硫酸钠除去水中溶解的氧,防止输水管被腐蚀,请简要说明原因。
四、综合题
-
22. 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
 (1)、电极X的材料是;电解质溶液Y是;(2)、银电极为电池的极,发生的电极反应为;X电极上发生的电极反应为;(3)、外电路中的电子是从电极流向电极.23. 银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。(1)、久存的银制器皿表面会变黑,失去银白色的光泽,原因是 。(2)、已知,Ksp=(AgCl)=1.8×10-10 , 若向50mL0.018mol/L的AgNO3溶液中加入50mL0.020mol/L的盐酸,混合后溶液中的Ag+的浓度为 mol/L,pH为 。(3)、AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为 。(4)、
(1)、电极X的材料是;电解质溶液Y是;(2)、银电极为电池的极,发生的电极反应为;X电极上发生的电极反应为;(3)、外电路中的电子是从电极流向电极.23. 银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。回答下列问题。(1)、久存的银制器皿表面会变黑,失去银白色的光泽,原因是 。(2)、已知,Ksp=(AgCl)=1.8×10-10 , 若向50mL0.018mol/L的AgNO3溶液中加入50mL0.020mol/L的盐酸,混合后溶液中的Ag+的浓度为 mol/L,pH为 。(3)、AgNO3溶液光照易分解,生成Ag和红棕色气体等物质,其光照分解的化学方程式为 。(4)、下图所示原电池正极的反应式为 。
 24. 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。(1)、原子序数为29的铜元素位于元素周期表中第 周期。(2)、某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为 。(3)、研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是A、降低了反应的活化能 B、增大了反应的速率 C、降低了反应的焓变 D、增大了反应的平衡常数(4)、采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为(5)、
24. 我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器大多受到环境腐蚀,故对其进行修复和防护具有重要意义。(1)、原子序数为29的铜元素位于元素周期表中第 周期。(2)、某青铜器中Sn、Pb的质量分别为119g、20.7g,则该青铜器中Sn和Pb原子的数目之比为 。(3)、研究发现,腐蚀严重的青铜器表面大都存在CuCl。关于CuCl在青铜器腐蚀过程中的催化作用,下列叙述正确的是A、降低了反应的活化能 B、增大了反应的速率 C、降低了反应的焓变 D、增大了反应的平衡常数(4)、采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为(5)、下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图。
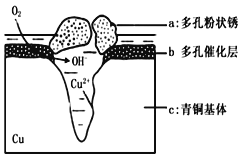
①腐蚀过程中,负极是 (填图中字母“a”或“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为 .
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为 L(标准状况)。
25.用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.
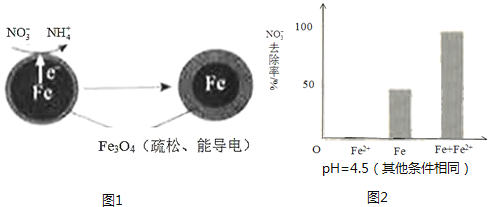 (1)、Fe还原水体中NO3﹣的反应原理如图1所示.
(1)、Fe还原水体中NO3﹣的反应原理如图1所示.①作负极的物质是 .
②正极的电极反应式是 .
(2)、将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如下:
初始pH
pH=2.5
pH=4.5
NO3﹣的去除率
接近100%
<50%
24小时pH
接近中性
接近中性
铁的最终物质形态


pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)、实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: .
(4)、其他条件与(2)相同,经1小时测定NO3﹣的去除率和pH,结果如表:初始pH
pH=2.5
pH=4.5
NO3﹣的去除率
约10%
约3%
1小时pH
接近中性
接近中性
与(2)中数据对比,解释(2)中初始pH不同时,NO3﹣去除率和铁的最终物质形态不同的原因: .
-