22017年高考化学备考复习专题八:化学反应与能量变化
试卷更新日期:2017-02-17 类型:二轮复习
一、单选题
-
1. 下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是( )A、
 电解水
B、
电解水
B、 水力发电
C、
水力发电
C、 太阳能热水器
D、
太阳能热水器
D、 干电池
2. 关于吸热反应的说法,正确的是( )A、凡需加热的反应一定是吸热反应 B、只有分解反应才是吸热反应 C、使用催化剂的反应是吸热反应 D、酸碱中和反应的逆反应是吸热反应3. 下列说法不正确的是( )A、反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 B、需要加热才能发生的反应一定是吸热反应 C、化学键的断裂和形成是化学反应中能量变化的主要原因 D、化学反应中的能量变化通常表现为热量的变化4. 下列叙述正确的是( )A、使用催化剂能够降低化学反应的反应热(△H) B、金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关 C、原电池中发生的反应达平衡时,该电池仍有电流产生 D、在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小5. 已知25℃、101kPa条件下:3O2(g)=2O3(g)△H=+284.2kJ•mol﹣1下列说法正确的是( )A、等质量的O2比O3能量低,由O2变O3为吸热反应 B、等质量的O2比O3能量高,由O2变O3为放热反应 C、O3比O2稳定,由O2变O3为吸热反应 D、O2比O3稳定,由O2变O3为放热反应6. 为探究NaHCO3、Na2CO3与1mol/L盐酸反应(设两反应分别是反应Ⅰ、反应Ⅱ)过程中的热效应,进行实验并测得如下数据:下列有关说法正确的是( )
干电池
2. 关于吸热反应的说法,正确的是( )A、凡需加热的反应一定是吸热反应 B、只有分解反应才是吸热反应 C、使用催化剂的反应是吸热反应 D、酸碱中和反应的逆反应是吸热反应3. 下列说法不正确的是( )A、反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 B、需要加热才能发生的反应一定是吸热反应 C、化学键的断裂和形成是化学反应中能量变化的主要原因 D、化学反应中的能量变化通常表现为热量的变化4. 下列叙述正确的是( )A、使用催化剂能够降低化学反应的反应热(△H) B、金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关 C、原电池中发生的反应达平衡时,该电池仍有电流产生 D、在同浓度的盐酸中,ZnS可溶而CuS不溶,说明CuS的溶解度比ZnS的小5. 已知25℃、101kPa条件下:3O2(g)=2O3(g)△H=+284.2kJ•mol﹣1下列说法正确的是( )A、等质量的O2比O3能量低,由O2变O3为吸热反应 B、等质量的O2比O3能量高,由O2变O3为放热反应 C、O3比O2稳定,由O2变O3为吸热反应 D、O2比O3稳定,由O2变O3为放热反应6. 为探究NaHCO3、Na2CO3与1mol/L盐酸反应(设两反应分别是反应Ⅰ、反应Ⅱ)过程中的热效应,进行实验并测得如下数据:下列有关说法正确的是( )序号
液体
固体
混合前温度
混合后最高温度
①
35mL水
2.5g NaHCO3
20℃
18.5℃
②
35mL水
3.2g Na2CO3
20℃
24.3℃
③
35mL盐酸
2.5g NaHCO3
20℃
16.2℃
④
35mL盐酸
3.2g Na2CO3
20℃
25.1℃
A、仅通过实验③即可判断反应Ⅰ是吸热反应 B、仅通过实验④即可判断反应Ⅱ是放热反应 C、通过实验可判断出反应Ⅰ、Ⅱ分别是吸热反应、放热反应 D、通过实验可判断出反应Ⅰ、Ⅱ分别是放热反应、吸热反应7. 由右表提供数据及相关物质结构知识,反应:SiCl4(g)+2H2(g)→Si(s)+4HCl(g),生成1mol晶体硅的热效应是( )化学键
Si﹣Cl
H﹣H
Si﹣Si
H﹣Cl
键能(kJ/mol)
360
436
176
431
A、吸收236KJ B、放出236kJ C、放出116kJ D、吸收116kJ8. 通过以下反应均可获取H2 . 下列有关说法正确的是( )①太阳光催化分解水制氢:2H2O(l)═2H2(g)+O2(g)△H1=571.6kJ•mol﹣1
②焦炭与水反应制氢:C(s)+H2O(g)═CO(g)+H2(g)△H2=131.3kJ•mol﹣1
③甲烷与水反应制氢:CH4(g)+H2O(g)═CO(g)+3H2(g)△H3=206.1kJ•mol﹣1 .
A、反应①中电能转化为化学能 B、反应②为放热反应 C、反应③使用催化剂,△H3减小 D、反应CH4(g)═C(s)+2 H2(g)的△H=74.8kJ•mol﹣19. 油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)
已知燃烧1kg该化合物释放出热量3.8×104kJ,油酸甘油酯的燃烧热为( )
A、3.8×104kJ•mol﹣1 B、﹣3.8×104kJ•mol﹣1 C、3.4×104kJ•mol﹣1 D、﹣3.4×104kJ•mol﹣110. 已知下列热化学方程式:Zn(s)+ O2(g)═ZnO(s)△H=﹣351.1kJ•mol﹣1
Hg(l)+ O2(g)═HgO(s)△H=﹣90.7kJ•mol﹣1
由此可知反应Zn(s)+HgO(s)═ZnO(s)+Hg(l)的焓变△H为( )
A、﹣260.4 kJ•mol﹣1 B、﹣441.8 kJ•mol﹣1 C、+260.4 kJ•mol﹣1 D、+441.8 kJ•mol﹣111. 已知下列热化学方程式:(1) C(s)+O2(g)=CO(g)△H=△H1;(2)2H2(g)+O2(g)=2H2O(g)△H=△H2;由此可知 C(s)+H2O(g)═CO(g)+H2(g)△H3 . 则△H3等于( )
A、△H1﹣△H2 B、△H1﹣ △H2 C、2△H1﹣△H2 D、△H2﹣△H112. 已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )A、H2O(g)=H2(g)+ O2(g)△H=+242kJ•mol﹣1 B、2H2(g)+O2(g)=2H2O(l)△H=﹣484kJ•mol﹣1 C、H2(g)+ O2(g)=H2O(g)△H=+242kJ•mol﹣1 D、2H2(g)+O2(g)=2H2O(g)△H=+484kJ•mol﹣113. 已知下列热化学方程式:①Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25kJ•mol﹣1
②3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=﹣47kJ•mol﹣1
则下列关于Fe3O4(s)被CO还原成Fe(s)和CO2的热化学方程式的书写中正确的是( )
A、Fe3O4+4CO═3Fe+4CO2/△H=﹣14kJ•mol﹣1 B、Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=﹣22kJ•mol﹣1 C、Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=+14kJ•mol﹣1 D、Fe3O4(s)+4CO(g)═3Fe(s)+4CO2(g)△H=﹣14kJ•mol﹣114. 已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是( )A、X的能量一定低于M的,Y的能量一定低于N的 B、因为该反应为吸热反应,故一定要加热反应才能进行 C、破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 D、X和Y的总能量一定低于M和N的总能量15. 已知反应A+B=C+D的能量变化如图所示,下列说法正确的是( )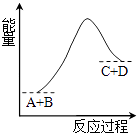 A、该反应为放热反应 B、该反应为吸热反应 C、反应物的总能量高于生成物的总能量 D、该反应只有在加热条件下才能进行16.
A、该反应为放热反应 B、该反应为吸热反应 C、反应物的总能量高于生成物的总能量 D、该反应只有在加热条件下才能进行16.下列图示与对应的叙述不相符合的是( )
 A、图甲表示燃料燃烧反应的能量变化 B、图乙表示酶催化反应的反应速率随反应温度的变化 C、图丙表示弱电解质在水中建立电离平衡的过程 D、图丁表示强碱滴定强酸的滴定曲线17.
A、图甲表示燃料燃烧反应的能量变化 B、图乙表示酶催化反应的反应速率随反应温度的变化 C、图丙表示弱电解质在水中建立电离平衡的过程 D、图丁表示强碱滴定强酸的滴定曲线17.某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在有图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热.下列说法正确的是( )
 A、实验过程中没有热量损失 B、烧杯间填满碎纸条的作用是固定小烧杯 C、图中实验装置缺少环形玻璃搅拌棒 D、若将盐酸体积改为60mL,理论上所求中和热不相等18. 化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )A、“无磷洗涤剂”的推广使用,不能有效减少水体富营养化的发生 B、无论是风力发电还是火力发电,都是将化学能转化为电能 C、PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 D、硫的氧化物和氮的氧化物是形成酸雨的主要物质19. 强酸和强碱的稀溶液中和热可表示为:H+(aq)+OH﹣(aq)⇌H2O(l)△H=﹣57.3kJ/mol以下4个化学方程式中,
A、实验过程中没有热量损失 B、烧杯间填满碎纸条的作用是固定小烧杯 C、图中实验装置缺少环形玻璃搅拌棒 D、若将盐酸体积改为60mL,理论上所求中和热不相等18. 化学与能源开发、环境保护、资源利用等密切相关.下列说法正确的是( )A、“无磷洗涤剂”的推广使用,不能有效减少水体富营养化的发生 B、无论是风力发电还是火力发电,都是将化学能转化为电能 C、PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素 D、硫的氧化物和氮的氧化物是形成酸雨的主要物质19. 强酸和强碱的稀溶液中和热可表示为:H+(aq)+OH﹣(aq)⇌H2O(l)△H=﹣57.3kJ/mol以下4个化学方程式中,①H2SO4(aq)+2NaOH(aq)=Na2SO4(aq)+2H2O(l)
②H2SO4(aq)+Ba(OH)2(aq)=BaSO4(aq)+2H2O(l)
③NH3•H2O(aq)+HCl=NH4Cl(aq)+H2O(l)
④NH3•H2O(aq)+CH3COOH(aq)=CH3COONH4(aq)+H2O(l)
其中反应热为﹣57.3kJ/mol的是( )
A、①② B、③ C、④ D、均不符合20. 下列说法正确的是( )A、已知ag乙烯气体充分燃烧时生成1molCO2和液态水,放出bkJ的热量,则表示乙烯燃烧热的热化学方程式为2C2H4(g)+6O2(g)═4CO2(g)+4H2O(l)△H=﹣4b kJ•mol﹣1 B、已知:H2(g)+F2(g)═2HF(g)△H=﹣270kJ•mol﹣1 , 则1mol氢气与1mol氟气反应生成2mol液态氟化氢放出的热量数值小于270kJ C、 常温常压下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)⇌2NH3(g)△H=﹣38.6kJ•mol﹣1 D、已知:①C(s,石墨)+O2(g)═CO2(g)△H=﹣393.5kJ•mol﹣1 , ②C(s,金刚石)+O2(g)═CO2(g)△H=﹣395.0kJ•mol﹣1则C(s,金刚石)═C(s,石墨)△H=﹣1.5kJ•mol﹣1二、填空题
-
21. 从能量的角度看,断开化学键要 , 形成化学键要 . 已知拆开1mol H﹣H键、1mol I﹣I、1mol H﹣I键分别需要吸收的能量为436kJ、151k J、299k J.则由氢气和碘反应生成1mol HI需要(填“放出”或“吸收”) k J的热量.当反应物的总能量高于生成物总能量时,该反应为反应;当反应物的总能量低于生成物总能量时,该反应为反应.22. 以下反应:①木炭与水制备水煤气②氯酸钾分解③炸药爆炸④酸与碱的中和反应⑤生石灰与水作用制熟石灰⑥Ba(OH)2•H2O与NH4Cl,属于放热反应(填序号),写出反应⑥的化学方程式 .23. 固态硫加热形成气态硫要吸收能量:1mol固态硫燃烧生成二氧化硫气体的焓变为△H1;1mol气态硫燃烧生成二氧化硫气体的焓变为△H2 , 则△H1 △H2 .24. 红磷(P)和白磷(P4)均为磷的同素异形体.已知:
P4(白磷、s)+5O2(g)═P4O10(s)△H═﹣2983.2kJ/mol
P(红磷、s)+ O2(g)═ P4O10(s)△H═﹣738.5kJ/mol
写出白磷转化为红磷的热化学方程式 , 由此可知,红磷比白磷 . (填“稳定”或“不稳定”)
25. 由金红石(TiO2)制取单质Ti,涉及的步骤为:TiO2→TiCl4 Ti已知:①C(s)+O2(g)═CO2(g);△H=﹣393.4KJ/mol
②2CO(g)+O2(g)═2CO2(g);△H=﹣556KJ/mol
③TiO2(s)+2Cl2(g)═TiCl4(s)+O2(g);△H=+141KJ/mol
则:TiO2(s)+2Cl2(g)+2C(s)═TiCl4(s)+2CO2(g);△H= .
三、综合题
-
26. 已知下列热化学方程式:2H2(g)+O2(g)=2H2O(l)△H=﹣571.6kJ/mol,H2(g)+O2(g)=H2O(l)△H=﹣285.8kJ/mol,C(s)+O2(g)=CO (g)△H=﹣110.5KJ/moL,C(s)+O2(g)=CO2(g)△H=﹣393.5KJ/moL.回答下列各问题:(1)、H2的燃烧热为 ,C的燃烧热为(2)、燃烧10gH2生成液态水,放出的热量为(3)、盖斯定律在生产和科学研究中有很重要的意义,有些反应的反应热虽然无法直接测得,但可通过间接的方法测定,则由已知条件得CO的燃烧热为 ,其燃烧热的热化学方程式为27. 联氨(又称肼,N2H4 , 无色液体)是一种应用广泛的化工原料,可用作火箭燃料.回答下列问题:(1)、联氨分子的电子式为 , 其中氮的化合价为 .(2)、实验室中可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为 .(3)、①2O2(g)+N2(g)═N2O4(l)△H1
②N2(g)+2H2(g)═N2H4(l)△H2
③O2(g)+2H2(g)═2H2O(g)△H3
④2N2H4(l)+N2O4(l)═3N2(g)+4H2O(g)△H4=﹣1048.9kJ•mol﹣1
上述反应热效应之间的关系式为△H4= , 联氨和N2O4可作为火箭推进剂的主要原因为 .
(4)、 联氨为二元弱碱,在水中的电离方式与氨相似.联氨第一步电离反应的平衡常数值为(已知:N2H4+H+⇌N2H5+的K=8.7×107;Kw=1.0×10﹣14).联氨与硫酸形成的酸式盐的化学式为 .(5)、联氨是一种常用的还原剂.向装有少量AgBr的试管中加入联氨溶液,观察到的现象是 . 联氨可用于处理高压锅炉水中的氧,防止锅炉被腐蚀.理论上1kg的联氨可除去水中溶解的O2kg;与使用Na2SO3处理水中溶解的O2相比,联氨的优点是 .28. 催化还原CO2是解决温室效应及能源问题的重要手段之一,研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO,反应的热化学方程式如下:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H1=﹣53.7kJ•mol﹣1 Ⅰ
CO2(g)+H2(g)⇌CO(g)+H2O(g)△H2 Ⅱ
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
T(K)
催化剂
CO2转化率(%)
甲醇选择性(%)
543
Cat.1
12.3
42.3
543
Cat.2
10.9
72.7
553
Cat.1
15.3
39.1
553
Cat.2
12.0
71.6
[备注]Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性;转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为﹣283.0kJ•mol﹣1和﹣285.8kJ•mol﹣1 .
②H2O(1)═H2O(g)△H3=44.0kJ•mol﹣1
请回答(不考虑温度对△H的影响):
(1)、反应I的平衡常数表达式K=;反应Ⅱ的△H2=kJ•mol﹣1 .(2)、有利于提高CO2转化为CH3OH平衡转化率的措施有 .A、使用催化剂Cat.1 B、使用催化剂Cat.2 C、降低反应温度 D、投料比不变,增加反应物的浓度 E、增大 CO2和H2的初始投料比(3)、表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是 .(4)、在如图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程﹣能量”示意图. (5)、研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在极,该电极反应式是 .
(5)、研究证实,CO2也可在酸性水溶液中通过电解生成甲醇,则生成甲醇的反应发生在极,该电极反应式是 .