2016-2017学年湖南省株洲市醴陵二中、醴陵四中两校联考高二上学期期中化学试卷
试卷更新日期:2017-02-17 类型:期中考试
一、选择题
-
1. 下列反应属于吸热反应的是( )A、炭燃烧生成一氧化碳 B、Ba(OH)2•8H2O与NH4Cl反应 C、锌粒与稀硫酸反应制取H2 D、中和反应2. 在下列各说法中,正确的是( )A、△H>0表示放热反应,△H<0表示吸热反应 B、0.5 mol H2SO4与0.5 mol Ba(OH)2完全反应生成BaSO4时放出的热叫做中和热 C、1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 D、热化学方程式中的化学计量数只表示物质的量,可以是分数3. 室温下,将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,其过程表示为:
CuSO4•5H2O(s)=Cu2+(aq)+SO42﹣(aq)+5H2O(l) 热效应为△H1;将 1mol CuSO4(s)溶于水会使溶液温度升高,其过程表示为:CuSO4(s)=Cu2+(aq)+SO42﹣(aq) 热效应为△H2;CuSO4•5H2O受热分解的化学方程式为:CuSO4•5H2O(s) CuSO4(s)+5H2O(l),热效应为△H3 . 则下列判断正确的是( )
A、△H1<△H3 B、△H2>△H3 C、△H1+△H3=△H2 D、△H1+△H2>△H34. 将1mol X、3mol Y充入一个密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+3Y(g)⇌2Z(g);△H<0.当改变某个条件并达到新平衡后,叙述正确的是( )A、升高温度,X的体积分数减小 B、缩小体积,Y的物质的量浓度不变 C、保持容器体积不变,充入一定量的稀有气体,Z的浓度不变 D、保持容器体积不变,充入一定量的Z,X的体积分数增大5. 对于可逆反应:2A(g)+B(g)⇌2C(g)△H<0,下列各图中正确的是( )A、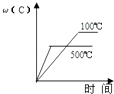 B、
B、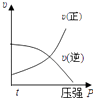 C、
C、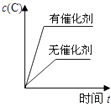 D、
D、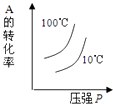 6. 反应L(s)+aG(g)⇌bR(g)达到平衡时,温度和压强对该反应的影响如图所示.图中:压强p1>p2 , x轴表示温度,y轴表示平衡混合气体中G的体积分数,据此可以判断( )
6. 反应L(s)+aG(g)⇌bR(g)达到平衡时,温度和压强对该反应的影响如图所示.图中:压强p1>p2 , x轴表示温度,y轴表示平衡混合气体中G的体积分数,据此可以判断( ) A、上述反应是放热反应 B、上述反应是吸热反应 C、a>b D、a<b7. 在密闭容器中发生如下反应:mA(g)+nB(g)⇌pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的 ,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )A、m+n>p B、平衡向逆反应方向移动 C、A的转化率提高 D、C的体积分数增加8. 在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)⇌Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
A、上述反应是放热反应 B、上述反应是吸热反应 C、a>b D、a<b7. 在密闭容器中发生如下反应:mA(g)+nB(g)⇌pC(g),达到平衡后,保持温度不变,将气体体积缩小到原来的 ,当达到新平衡时,C的浓度为原来的1.9倍,下列说法正确的是( )A、m+n>p B、平衡向逆反应方向移动 C、A的转化率提高 D、C的体积分数增加8. 在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)⇌Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:温度/℃
25
80
230
平衡常数
5×104
2
1.9×10﹣5
下列说法不正确的是( )
A、上述生成Ni(CO)4(g)的反应为放热反应 B、25℃时反应Ni(CO)4(g)⇌Ni(s)+4CO(g)的平衡常数为2×10﹣5 C、80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO)4的平衡浓度为2 mol/L D、在80℃时,测得某时刻,Ni(CO)4、CO浓度均为0.5 mol/L,则此时v(正)>v(逆)9. 下列电离方程式不正确的是( )A、醋酸溶于水:CH3COOH═CH3COO﹣+H+ B、Na2SO4溶于水:Na2SO4═2Na++SO42﹣ C、碳酸氢钠溶于水:NaHCO3═HCO3﹣+Na+ D、次氯酸溶于水:HClO⇌H++ClO﹣10. 某学生的实验报告所列出的下列数据中合理的是( )A、用10 mL量筒量取7.13 mL盐酸 B、用广泛pH试纸测得某溶液的pH为2.3 C、用25mL酸式滴定管量取21.70 mLKMnO4溶液 D、用托盘天平称量25.20 g NaCl11. 室温下,向a mol/L氨水中逐滴加入盐酸,下列描述不正确的是( )A、pH逐渐减小 B、 增大 C、水的电离程度会不断增大 D、Kw不变12. 已知温度T时水的离子积常数为KW . 该温度下,将浓度为a mol/L的一元酸HA与b mol/L的一元碱BOH等体积混合,可判定该溶液呈中性的依据是( )A、a=b B、混合溶液中,c(H+)= mol/L C、混合溶液的pH=7 D、混合溶液中,c(H+)+c(B+)=c(OH﹣)+c(A﹣)13. 常温下,下列各组离子一定能在指定溶液中大量共存的是( )A、使酚酞变红色的溶液中:Na+、Al3+、SO42﹣、Cl﹣ B、水电离的c(H+)=1×10﹣13mol•L﹣1的溶液中:K+、Na+、AlO2﹣、CO32﹣ C、 =1×10﹣13mol•L﹣1的溶液中:NH4+、Ba2+、Cl﹣、NO3﹣ D、与Al反应能放出H2的溶液中:Fe2+、K+、NO3﹣、SO42﹣14. 用酸碱中和滴定的方法测定NaOH和Na2CO3的混合液中的NaOH含量时,可先在混合液中加过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,然后用标准盐酸滴定(用酚酞作指示剂),下列有关实验的说法正确的是( )A、向混有BaCO3沉淀的NaOH溶液中滴入盐酸,不会影响NaOH含量的测定 B、滴定时,若滴定管中滴定液一直下降到活塞处才达到滴定终点,则不会影响计算结果 C、若用甲基橙作指示剂,则测定结果偏小 D、可以不用将Na2CO3完全变成BaCO3沉淀,直接滴加标准盐酸,至不再有气泡产生15. 各可逆反应达平衡后,改变反应条件,其变化趋势正确的是( )A、 向100mL 0.1mol/L醋酸溶液中逐渐加入醋酸钠晶体过程中溶液pH的变化趋势图
B、
向100mL 0.1mol/L醋酸溶液中逐渐加入醋酸钠晶体过程中溶液pH的变化趋势图
B、 向FeCl3溶液和KSCN溶液混合后反应达平衡后,向混合液中逐渐加入固体KCl过程中c(Fe3+)的变化趋势图
C、
向FeCl3溶液和KSCN溶液混合后反应达平衡后,向混合液中逐渐加入固体KCl过程中c(Fe3+)的变化趋势图
C、 密闭容器中进行N2(g)+3H2(g)⇌2NH3(g)反应达到平衡后,保持恒温恒压条件下,逐渐通入稀有气体Ar的过程中H2的转化率变化趋势图
D、
密闭容器中进行N2(g)+3H2(g)⇌2NH3(g)反应达到平衡后,保持恒温恒压条件下,逐渐通入稀有气体Ar的过程中H2的转化率变化趋势图
D、 密闭容器中进行CH3OCH3(g)+3H2O(g)⇌6H2(g)+2CO2(g)△H>0达到平衡后,保持恒压条件下,逐渐升高温度过程中CH3OCH3的转化率变化趋势图
16. pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示.分别滴加NaOH溶液(c=0.1mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy , 则( )
密闭容器中进行CH3OCH3(g)+3H2O(g)⇌6H2(g)+2CO2(g)△H>0达到平衡后,保持恒压条件下,逐渐升高温度过程中CH3OCH3的转化率变化趋势图
16. pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示.分别滴加NaOH溶液(c=0.1mol/L)至pH=7,消耗NaOH溶液的体积为Vx、Vy , 则( ) A、x为弱酸,Vx<Vy B、x为强酸,Vx>Vy C、y为弱酸,Vx<Vy D、y为强酸,Vx>Vy
A、x为弱酸,Vx<Vy B、x为强酸,Vx>Vy C、y为弱酸,Vx<Vy D、y为强酸,Vx>Vy二、解答题
-
17. 在一定温度下,将2mol A和2mol B两种气体混合于2L密闭容器中,发生反应3A(g)+B(g)⇌xC(g)+2D(g),2min末反应达到平衡状态,生成0.8mol D,并测得C的浓度为0.4mol/L.由此推断:(1)、x值等于;(2)、A的转化率为;(3)、B的平衡浓度为 mol/L.18. 在一定条件下,密闭容器内发生可逆反应3A+m B⇌n C达到平衡.(1)、若A、C均为气体,B为固体,则平衡常数表达式为K=;(2)、若A、B、C均为气体,在减小压强时平衡正向移动,则3+mn(填“>”、“<”或“=”);(3)、若该反应在任何温度下都能自发进行,则△H<0,△S0(填“>”、“<”或“=”).19. pH在表示溶液的酸碱性方面有重要的应用,请按要求完成填空(1)、常温下,pH=12的NaOH溶液的其浓度c(NaOH)=mol/L(2)、常温下,某一元弱酸溶液的pH=1,其浓度 0.1mol/L(填“>”、“<”或“=”);(3)、常温下,将100mL 0.1mol/L醋酸溶液和50mL 0.2mol/LNaOH溶液均匀混合后,溶液显(填“酸性”、“碱性”或“中性”),其原因是;(请用相关的离子方程式作答)(4)、25℃时,若体积为Va、pH=a的某一元强酸HA与体积为Vb、pH=b的某一元强碱BOH混合恰好中和,且已知Va<Vb和a=0.5b,则 a的取值范围是 .20. 工业上用CO生产燃料甲醇.一定条件下发生反应:
CO(g)+2H2(g)⇌CH3OH(g)
 (1)、甲图是反应时CO和CH3OH(g)的浓度随时间变化情况.从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=;(2)、乙图表示该反应进行过程中能量的变化.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.该反应的焓变是(填“△H<0”或“△H>0”)反应,写出反应的热化学方程式:;选择适宜的催化剂(填“能”或“不能”)改变该反应的反应热.(3)、恒容条件下,下列措施中能使 增大的有 .
(1)、甲图是反应时CO和CH3OH(g)的浓度随时间变化情况.从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=;(2)、乙图表示该反应进行过程中能量的变化.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.该反应的焓变是(填“△H<0”或“△H>0”)反应,写出反应的热化学方程式:;选择适宜的催化剂(填“能”或“不能”)改变该反应的反应热.(3)、恒容条件下,下列措施中能使 增大的有 .a.升高温度 b.充入1mol He气c.再充入1mol CO和2mol H2d.使用催化剂.
21. 已知在密闭容器中反应A(g)+3B(g)⇌2C(g) 在一定温度下达到平衡,(1)、在平衡时测得各物质的物质的量分别为n(A)=1.0mol、n(B)=0.4mol、n(C)=0.4mol,此时容器体积为2L,则此条件下的平衡常数K= .(2)、若保持温度和压强不变,在(1)中平衡中向上述容器中通入0.36mol A (g),平衡将(填“正向”、“逆向”或“不”)移动,用简要的计算过程说明理由 .三、实验题
-
22. 用硫酸酸化的草酸(H2C2O4 , 二元弱酸)溶液能将KMnO4溶液中的MnO4﹣转化为Mn2+ . 某化学小组研究发现,少量MnSO4可对该反应起催化作用.为进一步研究有关因素对该反应速率的影响,探究如下:(1)、常温下,控制KMnO4溶液初始浓度相同,调节不同的初始pH和草酸溶液用量,做对比实验,请完成以下实验设计表.
实验
编号
温度
初始pH
0.1mol/L
草酸溶液/mL
0.01mol/L
KMnO4溶的
体积/mL
蒸馏水
体积/mL
待测数据(反应混合液褪色
时间/s)
①
常温
1
20
50
30
t1
②
常温
2
20
50
30
t2
③
常温
2
40
a
b
t3
表中a、b的值分别为:a=、b=
(2)、该反应的离子方程式 .(3)、若t1<t2 , 则根据实验①和②得到的结论是(4)、请你设计实验④验证MnSO4对该反应起催化作用,完成表中内容.实验方案(不要求写出具体操作过程)
预期实验结果和结论
若反应混合液褪色时间小于实验①中的t1 , 则MnSO4对该反应起催化作用(若褪色时间相同,则MnSO4对该反应无催化作用)
(5)、某化学小组用滴定法测定KMnO4溶液物质的量浓度:取W g草酸晶体(H2C2O4•2H2O,其摩尔质量126g/mol)溶于水配成250mL溶液,取25.00mL溶液置于锥形瓶中,加入适量稀H2SO4酸化,再用KMnO4溶液滴定至终点,重复滴定两次,平均消耗KMnO4溶液V mL.请回答下列问题:
①该测定方法中(填“需要”或“不需要”)加入指示剂;
②计算得KMnO4溶液的c(KMnO4)=mol/L.(请写出最后化简结果)