2015-2016学年湖北省宜昌市部分示范高中高一上学期期末化学试卷
试卷更新日期:2017-02-16 类型:期末考试
一、选择题
-
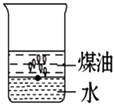
1. 下列各组混合物中,能用分液漏斗进行分离的是( )A、酒精和水 B、碘和四氯化碳 C、水和四氯化碳 D、汽油和植物油2. 向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一块绿豆大小的金属钠,可能观察到的现象符合下图中的( )A、
 B、
B、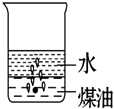 C、
C、 D、
D、 3. 下列各组物质中,所含分子数相等的是( )A、10g H2和10g O2 B、5.6g N2 (标准状况)和 11g CO2 C、9g H2O 和0.5mol Br2 D、224mL H2(标准状况)和0.1mol N24. 下列关于胶体的叙述中不正确的是( )A、丁达尔现象可用来区别胶体与溶液 B、胶体能透过半透膜 C、胶体的性质主要有:丁达尔现象、电泳、聚沉 D、溶液、胶体、浊液的根本区别是分散质微粒直径的大小5. 人们常用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可用图表示.如图为离子反应、氧化还原反应和置换反应三者之间的关系,则C表示( )
3. 下列各组物质中,所含分子数相等的是( )A、10g H2和10g O2 B、5.6g N2 (标准状况)和 11g CO2 C、9g H2O 和0.5mol Br2 D、224mL H2(标准状况)和0.1mol N24. 下列关于胶体的叙述中不正确的是( )A、丁达尔现象可用来区别胶体与溶液 B、胶体能透过半透膜 C、胶体的性质主要有:丁达尔现象、电泳、聚沉 D、溶液、胶体、浊液的根本区别是分散质微粒直径的大小5. 人们常用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可用图表示.如图为离子反应、氧化还原反应和置换反应三者之间的关系,则C表示( ) A、离子反应 B、氧化还原反应 C、置换反应 D、三者都可以6. 下列离子方程式书写正确的是( )A、铝粉投入到NaOH溶液中:2Al+2OH﹣═2AlO2﹣+H2↑ B、AlCl3溶液中加入足量的氨水:Al3++3OH﹣═Al(OH)3↓ C、三氯化铁溶液中加入铁粉Fe3++Fe=2Fe2+ D、FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl﹣7. 下列各组离子,在碱性溶液中能大量共存,且溶液为无色透明的是( )A、K+ MnO4﹣ Cl﹣ SO42﹣ B、Na+ Ba2+ NO3﹣ Cl﹣ C、Na+ SO42﹣ Cu2+ Cl﹣ D、Na+ H+ NO3﹣ SO42﹣8. 氯气是一种重要的工业原料,工业上利用反应3Cl2+2NH3═N2+6HCl检查氯气管道是否漏气,下列说法错误的是( )A、若管道漏气遇氨就会产生白烟 B、该反应利用了Cl2的强氧化性 C、该反应NH3被还原 D、生成1 mol N2有6 mol电子转移9. 为了除去粗盐中的Ca2+、Mg2+、SO 可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量氢氧化钠;③加适量盐酸;④加足量碳酸钠溶液;⑤加过量氯化钡溶液.下列操作顺序正确的是( )A、①④②⑤③ B、④①②⑤③ C、④②⑤①③ D、⑤②④①③10. 下面有关Na2CO3与NaHCO3的性质比较中错误的是( )A、相同浓度溶液的碱性:Na2CO3>NaHCO3 B、在水中的溶解度:Na2CO3>NaHCO3 C、与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3 D、热稳定性:NaHCO3<Na2CO311. 取两份等量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状态下产生的气体体积之比是( )A、1:1 B、1:2 C、1:3 D、3:212. 向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液.下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)( )A、
A、离子反应 B、氧化还原反应 C、置换反应 D、三者都可以6. 下列离子方程式书写正确的是( )A、铝粉投入到NaOH溶液中:2Al+2OH﹣═2AlO2﹣+H2↑ B、AlCl3溶液中加入足量的氨水:Al3++3OH﹣═Al(OH)3↓ C、三氯化铁溶液中加入铁粉Fe3++Fe=2Fe2+ D、FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl﹣7. 下列各组离子,在碱性溶液中能大量共存,且溶液为无色透明的是( )A、K+ MnO4﹣ Cl﹣ SO42﹣ B、Na+ Ba2+ NO3﹣ Cl﹣ C、Na+ SO42﹣ Cu2+ Cl﹣ D、Na+ H+ NO3﹣ SO42﹣8. 氯气是一种重要的工业原料,工业上利用反应3Cl2+2NH3═N2+6HCl检查氯气管道是否漏气,下列说法错误的是( )A、若管道漏气遇氨就会产生白烟 B、该反应利用了Cl2的强氧化性 C、该反应NH3被还原 D、生成1 mol N2有6 mol电子转移9. 为了除去粗盐中的Ca2+、Mg2+、SO 可将粗盐溶于水,然后进行下列五项操作:①过滤;②加过量氢氧化钠;③加适量盐酸;④加足量碳酸钠溶液;⑤加过量氯化钡溶液.下列操作顺序正确的是( )A、①④②⑤③ B、④①②⑤③ C、④②⑤①③ D、⑤②④①③10. 下面有关Na2CO3与NaHCO3的性质比较中错误的是( )A、相同浓度溶液的碱性:Na2CO3>NaHCO3 B、在水中的溶解度:Na2CO3>NaHCO3 C、与同浓度的硫酸反应放出气泡的速率:NaHCO3<Na2CO3 D、热稳定性:NaHCO3<Na2CO311. 取两份等量的铝粉,分别与足量的盐酸、浓氢氧化钠溶液反应,在相同状态下产生的气体体积之比是( )A、1:1 B、1:2 C、1:3 D、3:212. 向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液.下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)( )A、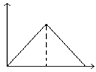 B、
B、 C、
C、 D、
D、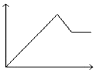 13. 对于某些离子的检验及结论一定正确的是( )A、某物质进行焰色反应时呈现黄色,则该物质中一定含有Na+ B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42﹣ C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+14. 下列表格中各项都正确的一组是( )
13. 对于某些离子的检验及结论一定正确的是( )A、某物质进行焰色反应时呈现黄色,则该物质中一定含有Na+ B、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42﹣ C、加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ D、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+14. 下列表格中各项都正确的一组是( )类别
选项
碱
盐
电解质
非电解质
A
烧碱
小苏打
BaSO4
干冰
B
纯碱
CaCO3
NH3•H2O
Fe
C
胆矾
食盐
石墨
醋酸
D
KOH
CuSO4
Na2SO4
KClO3
A、A B、B C、C D、D15. 下列物质的转化能实现的是( )A、Na Na2O Na2O2 B、AlCl3 Al(OH)3 NaAlO2 C、NaOH Na2CO3 NaHCO3 D、Fe FeCl2 FeCl316. 把一定量铁粉放入氯化铁溶液中,完全反应后,得到溶液中Fe2+和Fe3+的浓度恰好相等.则已反应的Fe3+和未反应的Fe3+的物质的量之比为( )A、1:1 B、1:2 C、2:3 D、3:2二、填空题
-
17. 有下列物品或设备:
①陶瓷餐具 ②砖瓦③水泥路桥 ④门窗玻璃⑤水晶镜片 ⑥石英钟表⑦玛瑙手镯 ⑧硅太阳电池⑨光导纤维 ⑩计算机芯片
(1)、用到硅单质的是 .(2)、所用材料为SiO2或要用到SiO2的是(3)、所用材料为硅酸盐的是 .18. 按要求用化学用语回答下列问题:(1)、除去混入Fe2O3粉末中少量Al2O3杂质的试是 , 离子方程式为 .(2)、在呼吸面具中,Na2O2起反应的化学方程式为 .(3)、镁带着火时,不能用液态CO2灭火剂来灭火的原因是 . (用化学方程式表示).(4)、氯气用于漂白、消毒时,能起漂白、消毒作用的物质是(写化学式).某研究性学习小组对漂白液进行了如下实验探究:取漂白液少量,滴入3~5滴紫色石蕊试液,发现溶液先变蓝色后褪色,可以证明漂白液具有的性质有 .
19. 某河道两旁有甲乙两厂,它们排放的工业废水中含有K+、Ag+、Fe3+、Cl﹣、OH﹣、NO3﹣六种杂质离子,甲厂的废水是无色透明的,乙厂的废水有明显的颜色.(1)、甲厂的废水中所含三种离子是 .(2)、乙厂的废水有明显的色(3)、将甲厂和乙厂的废水按适当的比例混合,可使废水中的(填离子符号)化为沉淀,过滤所得的废水中主要含 , 可用来灌农田.三、实验题
-
20. 某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3•6H2O晶体.(图中夹持及尾气处理装置均已略去)
 (1)、烧瓶底部放置了几片碎瓷片,
(1)、烧瓶底部放置了几片碎瓷片,碎瓷片的作用是
装置B中发生反应的化学方程式是 .
(2)、如果要在C处玻璃管处点燃该气体,则必须对该气体进行 ,装置E中的现象是 .
(3)、停止反应,待B管冷却后,取其中的固体,加入过量盐酸充分反应,过滤.简述检验滤液中Fe3+的操作方法 .(4)、该小组学生利用上述滤液制取FeCl3•6H2O晶体,设计流程如下:滤液 FeCl3溶液 FeCl3•6H2O晶体
步骤中通入Cl2的作用是 .
四、推断题
