2015-2016学年黑龙江省鹤岗市绥滨一中高一下学期期末化学试卷
试卷更新日期:2017-02-16 类型:期末考试
一、选择题
-
1. 2007年3月温家宝总理在十届全国人大五次会议上提出“要大力抓好节能降耗、保护环境”,下列举措与这一主题不相符的是( )A、用“绿色化学”工艺,使原料完全转化为目标产物 B、推广燃煤脱硫技术,减少SO2污染 C、推广垃圾的分类存放、回收、处理 D、大量使用农药化肥以提高粮食产量2. 下列各项中表达正确的是( )A、F﹣的结构示意图:
 B、乙烯的结构简式CH2CH2
C、NaCl的电子式:
B、乙烯的结构简式CH2CH2
C、NaCl的电子式:  D、N2的结构式:N≡N:
3. 北京奥运会开幕式在李宁点燃鸟巢主火炬时达到高潮.奥运火炬采用的是环保型燃料﹣﹣丙烷,其燃烧时发生反应的化学方程式为C3H8+5O2 3CO2+4H2O.下列说法中不正确的是( )A、火炬燃烧时化学能只转化为热能 B、所有的燃烧反应都会释放热量 C、1 mol C3H8和5 mol O2所具有的总能量大于3 mol CO2和4 mol H2O所具有的总能量 D、丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料4. 下列说法正确的是( )A、形成离子键的阴阳离子间只存在静电吸引力 B、HF,HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 C、第三周期非金属元素含氧酸的酸性从左到右依次增强 D、元素周期律是元素原子核外电子排布周期性变化的结果5. 下列物质的性质比较,正确的是( )A、酸性:H2SO4>HClO4>HBrO4 B、碱性:NaOH>KOH>RbOH C、非金属性:P>S>Cl D、气态氢化物稳定性:HF>HCl>H2S6. 下列反应中,不属于取代反应的是( )A、在催化剂存在条件下苯与溴反应制溴苯 B、苯与浓硝酸、浓硫酸混合共热制取硝基苯 C、在催化剂存在条件下,乙烯与氯化氢反应制氯乙烷 D、油脂在碱性条件下水解制肥皂7. X,Y,Z,W为短周期元素,它们在周期表的位置如图所示,若Y原子的最外层电子数是内层电子数的3倍.下列说法中错误的是( )
D、N2的结构式:N≡N:
3. 北京奥运会开幕式在李宁点燃鸟巢主火炬时达到高潮.奥运火炬采用的是环保型燃料﹣﹣丙烷,其燃烧时发生反应的化学方程式为C3H8+5O2 3CO2+4H2O.下列说法中不正确的是( )A、火炬燃烧时化学能只转化为热能 B、所有的燃烧反应都会释放热量 C、1 mol C3H8和5 mol O2所具有的总能量大于3 mol CO2和4 mol H2O所具有的总能量 D、丙烷完全燃烧的产物对环境无污染,故丙烷为环保型燃料4. 下列说法正确的是( )A、形成离子键的阴阳离子间只存在静电吸引力 B、HF,HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 C、第三周期非金属元素含氧酸的酸性从左到右依次增强 D、元素周期律是元素原子核外电子排布周期性变化的结果5. 下列物质的性质比较,正确的是( )A、酸性:H2SO4>HClO4>HBrO4 B、碱性:NaOH>KOH>RbOH C、非金属性:P>S>Cl D、气态氢化物稳定性:HF>HCl>H2S6. 下列反应中,不属于取代反应的是( )A、在催化剂存在条件下苯与溴反应制溴苯 B、苯与浓硝酸、浓硫酸混合共热制取硝基苯 C、在催化剂存在条件下,乙烯与氯化氢反应制氯乙烷 D、油脂在碱性条件下水解制肥皂7. X,Y,Z,W为短周期元素,它们在周期表的位置如图所示,若Y原子的最外层电子数是内层电子数的3倍.下列说法中错误的是( ) A、X的氢化物的水溶液显碱性 B、Y和Z只能组成一种化合物 C、Z的氧化物和Z的氢化物分别溶于水后,溶液均呈酸性 D、最高价氧化物对应水化物的酸性:W>Z8. 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )
A、X的氢化物的水溶液显碱性 B、Y和Z只能组成一种化合物 C、Z的氧化物和Z的氢化物分别溶于水后,溶液均呈酸性 D、最高价氧化物对应水化物的酸性:W>Z8. 将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( )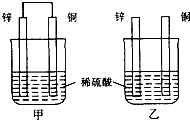 A、两烧杯中铜片表面均无气泡产生 B、甲中铜片是正极,乙中铜片是负极 C、两烧杯中溶液的pH均减小 D、产生气泡的速度甲比乙快9. 下列说法中不正确的是( )A、鉴定蔗糖水解产物中有葡萄糖:直接在水解液中加入新制Cu(OH)2悬浊液 B、鉴别某白色纺织品的成分是蚕丝还是“人造丝”,可用灼烧的方法 C、乙醇可以被酸性高锰酸钾溶液或酸性重铬酸钾溶液直接氧化成乙酸 D、醇CH3CHOHCH3能在铜或银作催化剂的条件下发生催化氧化反应10. 巴豆酸的结构简式为CH3﹣CH=CH﹣COOH.现有①氯化氢、②溴水、③纯碱溶液、④乙醇、⑤酸性高锰酸钾溶液,判断在一定条件下,能与巴豆酸反应的物质是( )A、只有②④⑤ B、只有①③④ C、只有①②③④ D、全部11. 两种气态烃以一定比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各组混合烃中不符合此条件的是( )A、CH4 C2H4 B、CH4 C3H6 C、C2H4 C3H4 D、C2H2 C3H612. 进行一氯取代后,只能生成三种沸点不同的有机物的烷烃是( )A、(CH3)2CHCH2CH2CH3 B、(CH3)2CHCH3 C、(CH3)2CHCH(CH3)2 D、(CH3)3CCH2CH313. 下列化工生产原理错误的是( )
A、两烧杯中铜片表面均无气泡产生 B、甲中铜片是正极,乙中铜片是负极 C、两烧杯中溶液的pH均减小 D、产生气泡的速度甲比乙快9. 下列说法中不正确的是( )A、鉴定蔗糖水解产物中有葡萄糖:直接在水解液中加入新制Cu(OH)2悬浊液 B、鉴别某白色纺织品的成分是蚕丝还是“人造丝”,可用灼烧的方法 C、乙醇可以被酸性高锰酸钾溶液或酸性重铬酸钾溶液直接氧化成乙酸 D、醇CH3CHOHCH3能在铜或银作催化剂的条件下发生催化氧化反应10. 巴豆酸的结构简式为CH3﹣CH=CH﹣COOH.现有①氯化氢、②溴水、③纯碱溶液、④乙醇、⑤酸性高锰酸钾溶液,判断在一定条件下,能与巴豆酸反应的物质是( )A、只有②④⑤ B、只有①③④ C、只有①②③④ D、全部11. 两种气态烃以一定比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各组混合烃中不符合此条件的是( )A、CH4 C2H4 B、CH4 C3H6 C、C2H4 C3H4 D、C2H2 C3H612. 进行一氯取代后,只能生成三种沸点不同的有机物的烷烃是( )A、(CH3)2CHCH2CH2CH3 B、(CH3)2CHCH3 C、(CH3)2CHCH(CH3)2 D、(CH3)3CCH2CH313. 下列化工生产原理错误的是( )①可以用电解熔融的氯化钠的方法来制取金属钠.
②可以用钠加入氯化镁饱和溶液中制取镁.
③用电解法制铝时,原料是氯化铝.
④炼铁高炉中所发生的反应都是放热的,故无需加热.
A、② B、②③ C、①②③ D、②③④14. 使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生取代反应全部生成C2H2Cl4 , 则两个过程中消耗的氯气的总的物质的量是( )A、3mol B、4mol C、5mol D、6mol15. 氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质的这种电池在使用时的电极反应如下:2H2+4OH﹣﹣4e﹣═4H2O O2+2H2O+4e﹣═4OH﹣下列说法错误的是( )A、氢气通入正极,氧气通入负极 B、燃料电池的能量转化率不能达到100% C、供电时的总反应为:2H2+O2═2H2O D、产物为无污染的水,属于环境友好电池16. 高温下,炽热的铁与水蒸气在一个体积可变的密闭容器中进行反应:3Fe(s)+4H2O(g)=Fe3O4(s)+4H2(g),下列条件的改变对其反应速率几乎无影响的是( )A、压强不变,充入氮气使容器体积增大 B、将容器的体积缩小一半 C、增加铁的量 D、体积不变,充入氮气使容器压强增大17. 等质量的下列有机物充分燃烧时,消耗氧气最多的是( )A、甲烷 B、乙烯 C、苯 D、乙醇18. 对于锌﹣铜﹣稀硫酸组成的原电池装置中,当导线中有1mol电子通过时,理论上的两极变化是( )①锌片溶解了32.5g ②锌片增重32.5g ③铜片上析出1g H2 ④铜片上析出1mol H2 .
A、①③ B、①④ C、②③ D、②④二、填空题
-
19. 填写下列空白:(1)、写出表示含有8个质子、8个中子的原子的化学符号: . 其在周期表中的位置为第周期族.(2)、元素周期表中最活泼的非金属元素位于第纵行.(3)、在NaCl、NaOH、N2、H2S中,只含有极性键的是 , 只含有离子键的是 , 既含有极性键又含有离子键的是 .20. 利用所学化学知识解答问题:(1)、在25℃、101kPa下,1g甲醇燃烧生成CO2和液态水时放热22.68kJ,则该反应的热化学方程式应为(2)、已知下列各物质的键能:N≡N 946kJ/mol、H﹣H 436kJ/mol、N﹣H 391kJ/mol,写出合成氨的热化学方程式为21. 在恒容的密闭容器中进行如下反应:A(g)+2B(g)⇌3C(g)+D(g),(1)、此反应在四种不同情况下的反应速率分别为:
①v(A)=5mol•L﹣1•min﹣1
②v(B)=6mol•L﹣1•min﹣1
③v(C)=4.5mol•L﹣1•min﹣1
④v(D)=8mol•L﹣1•min﹣1
其中反应速率最快的是 (填编号).
(2)、下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同) .A、容器内压强不再发生变化 B、C的体积分数不再发生变化 C、容器内气体原子总数不再发生变化 D、相同时间内消耗2n mol B的同时消耗n molA E、气体密度保持不变 F、气体的平均摩尔质量保持不变.22. 反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势如图所示: (1)、该反应为反应(填“吸热”或“放热”).(2)、若要使该反应的反应速率加快,下列措施可行的是 (填字母).A、改铁片为铁粉 B、改稀硫酸为98%的浓硫酸 C、升高温度(3)、若将上述反应设计成原电池,铜为原电池某一极材料,则铜为(填“正”或“负”)极.铜片上的现象为该极上发生的电极反应为 , 外电路中电子由极(填“正”或“负”,下同)向极移动.
(1)、该反应为反应(填“吸热”或“放热”).(2)、若要使该反应的反应速率加快,下列措施可行的是 (填字母).A、改铁片为铁粉 B、改稀硫酸为98%的浓硫酸 C、升高温度(3)、若将上述反应设计成原电池,铜为原电池某一极材料,则铜为(填“正”或“负”)极.铜片上的现象为该极上发生的电极反应为 , 外电路中电子由极(填“正”或“负”,下同)向极移动.三、实验题
-
23. 某化学兴趣设计实验制取乙酸乙酯.现用右图装置进行实验,在圆底烧瓶内加入碎瓷片,再加入由2mL98%的浓H2SO4和3mL乙醇组成的混合液,通过分液漏斗向烧瓶内加入2mL醋酸,烧杯中加入饱和Na2CO3溶液.请回答下列问题:
 (1)、写出圆底烧瓶内发生反应的化学方程式为: .(2)、反应中加入浓硫酸的作用是 .(3)、球形干燥管C的作用是 .(4)、反应结束后D中的现象是:(5)、分离出D中的乙酸乙酯时需要的玻璃仪器是 .24. 海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.某研究性学习小组设计如下实验从海带中提取碘,请你完成下面相关问题:
(1)、写出圆底烧瓶内发生反应的化学方程式为: .(2)、反应中加入浓硫酸的作用是 .(3)、球形干燥管C的作用是 .(4)、反应结束后D中的现象是:(5)、分离出D中的乙酸乙酯时需要的玻璃仪器是 .24. 海洋植物如海带中含有丰富的碘元素,碘元素以碘离子的形式存在.某研究性学习小组设计如下实验从海带中提取碘,请你完成下面相关问题:海带 海带灰 海带灰悬浊液 含I﹣的溶液 含I2的水溶液 含I2有机溶液 晶体碘.
(1)、步骤①的名称为 , 需要用到的仪器有 .(2)、步骤④的离子反应为 .(3)、步骤⑤的名称为 , 可供选择的试剂是(填编号).A.酒精 B.四氯化碳 C.乙酸 D.蔗糖溶液.
(4)、怎样检验步骤④后得到的溶液中含有碘单质 .(5)、步骤⑤的名称为 , 最后晶体碘在(填仪器名称)里聚集.四、计算题
-
25. 在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)⇌3C(g)+nD(g),开始时A为4mol,B为6mol,5 min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2mol•L﹣1•min﹣1 .
计算:
(1)、5min末A的物质的量浓度,(2)、B的转化率为.(3)、前5min内用B表示的化学反应速率v(B).(4)、化学方程式中n值.