2018年高考化学真题分类汇编专题15:物质的制备
试卷更新日期:2018-08-01 类型:二轮复习
一、单选题
-
1. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、
二、实验探究题
-
2. 以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3 , 其主要实验流程如下:

已知:①Cl2+2OH−=ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)、步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为;实验中控制温度除用冰水浴外,还需采取的措施是。(2)、步骤Ⅱ合成N2H4·H2O的装置如题19图−1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是;使用冷凝管的目的是。 (3)、步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、 、 随pH的分布如题19图−2所示,Na2SO3的溶解度曲线如题19图−3所示)。
(3)、步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、 、 随pH的分布如题19图−2所示,Na2SO3的溶解度曲线如题19图−3所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: , 用少量无水乙醇洗涤,干燥,密封包装。
3. 下图中反应①是制备SiH4的一种方法,其副产物MgCl2·6NH3是优质的镁资源。回答下列问题: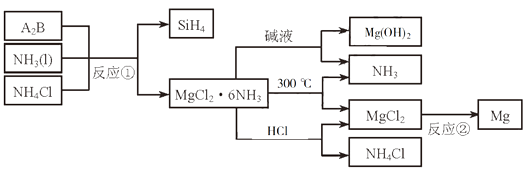 (1)、MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外): , Mg在元素周期表中的位置: , Mg(OH)2的电子式:。(2)、A2B的化学式为。反应②的必备条件是。上图中可以循环使用的物质有。(3)、在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料(写化学式)。(4)、为实现燃煤脱硫,向煤中加入浆状Mg(OH)2 , 使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:。(5)、用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下:
(1)、MgCl2·6NH3所含元素的简单离子半径由小到大的顺序(H-除外): , Mg在元素周期表中的位置: , Mg(OH)2的电子式:。(2)、A2B的化学式为。反应②的必备条件是。上图中可以循环使用的物质有。(3)、在一定条件下,由SiH4和CH4反应生成H2和一种固体耐磨材料(写化学式)。(4)、为实现燃煤脱硫,向煤中加入浆状Mg(OH)2 , 使燃烧产生的SO2转化为稳定的Mg化合物,写出该反应的化学方程式:。(5)、用Mg制成的格氏试剂(RMgBr)常用于有机合成,例如制备醇类化合物的合成路线如下: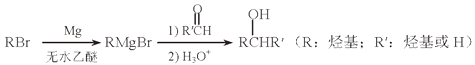
依据上述信息,写出制备
 所需醛的可能结构简式:。4. 醋酸亚铬[( CH3 COO)₂Cr·2H₂O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂,一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题:
所需醛的可能结构简式:。4. 醋酸亚铬[( CH3 COO)₂Cr·2H₂O]为砖红色晶体,难溶于冷水,易溶于酸,在气体分析中用作氧气吸收剂,一般制备方法是先在封闭体系中利用金属锌作还原剂,将三价铬还原为二价铬;二价铬再与醋酸钠溶液作用即可制得醋酸亚铬。实验装置如图所示,回答下列问题: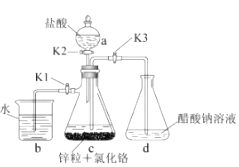 (1)、实验中所用蒸馏水均需经煮沸后迅速冷却,目的是 , 仪器a的名称是。(2)、将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开
(1)、实验中所用蒸馏水均需经煮沸后迅速冷却,目的是 , 仪器a的名称是。(2)、将过量锌粒和氯化铬固体置于c中,加入少量蒸馏水,按图连接好装置,打开K1 , K2 , 关闭K3。
①c中溶液由绿色逐渐变为亮蓝色,该反应的离子方程式为。
②同时c中有气体产生,该气体的作用是。
(3)、打开K3 , 关闭K1和K2。c中亮蓝色溶液流入d,其原因是;d中析出砖红色沉淀,为使沉淀充分析出并分离,需采用的操作是、、洗涤、干燥。(4)、指出装置d可能存在的缺点。三、综合题
-
5. 以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2 , 少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
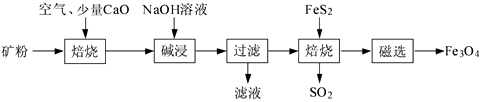 (1)、焙烧过程均会产生SO2 , 用NaOH溶液吸收过量SO2的离子方程式为。(2)、添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。
(1)、焙烧过程均会产生SO2 , 用NaOH溶液吸收过量SO2的离子方程式为。(2)、添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。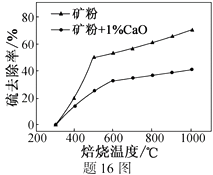
已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1— )×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是。
(3)、向“过滤”得到的滤液中通入过量CO2 , 铝元素存在的形式由(填化学式)转化为(填化学式)。(4)、“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2 , 理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=。6. CO2是一种廉价的碳资源,其综合利用具有重要意义。回答下列问题:(1)、CO2可以被NaOH溶液捕获。若所得溶液pH=13,CO2主要转化为(写离子符号);若所得溶液c(HCO3−)∶c(CO32−)=2∶1,溶液pH=。(室温下,H2CO3的K1=4×10−7;K2=5×10−11)(2)、CO2与CH4经催化重整,制得合成气:CH4(g)+ CO2(g) 2CO (g)+ 2H2(g)
①已知上述反应中相关的化学键键能数据如下:
化学键
C—H
C=O
H—H
C
 O(CO)
O(CO)键能/kJ·mol−1
413
745
436
1075
则该反应的ΔH=。分别在VL恒温密闭容器A(恒容)、B(恒压,容积可变)中,加入CH4和CO2各1 mol的混合气体。两容器中反应达平衡后放出或吸收的热量较多的是(填“A” 或“B ”)。
②按一定体积比加入CH4和CO2 , 在恒压下发生反应,温度对CO和H2产率的影响如图3所示。此反应优选温度为900℃的原因是。
 (3)、O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2 , 电池反应产物Al2(C2O4)3是重要的化工原料。
(3)、O2辅助的Al~CO2电池工作原理如图4所示。该电池电容量大,能有效利用CO2 , 电池反应产物Al2(C2O4)3是重要的化工原料。电池的负极反应式:。
电池的正极反应式:6O2+6e−=6O2−
6CO2+6O2−=3C2O42−
反应过程中O2的作用是。
该电池的总反应式:。
7. 磷精矿湿法制备磷酸的一种工艺流程如下:
已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)、上述流程中能加快反应速率的措施有。(2)、磷精矿粉酸浸时发生反应:①该反应体现出酸性关系: H3PO4 H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,。
(3)、酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:。(4)、H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。800C后脱除率变化的原因:。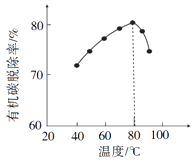 (5)、脱硫时,CaCO3稍过量,充分反应后仍有SO24-残留,原因是:;加入BaCO3可进一步提高硫的脱除率,其离子方程式是。(6)、取ag所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用bmol·L-1NaOH溶液滴定至终点时生成Na2HPO4 , 消耗NaOH溶液cmL,精制磷酸中H3PO4的质量分数是。(已知:H3PO4摩尔质量为98g·mol-1)8. 我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有 和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
(5)、脱硫时,CaCO3稍过量,充分反应后仍有SO24-残留,原因是:;加入BaCO3可进一步提高硫的脱除率,其离子方程式是。(6)、取ag所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用bmol·L-1NaOH溶液滴定至终点时生成Na2HPO4 , 消耗NaOH溶液cmL,精制磷酸中H3PO4的质量分数是。(已知:H3PO4摩尔质量为98g·mol-1)8. 我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有 和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
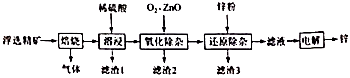
相关金属离子 形成氢氧化物沉淀的pH范围如下:
回答下列问题:金属离子 开始沉淀的pH 1.5 6.3 6.2 7.4 沉淀完全的pH 2.8 8.3 8.2 9.4 (1)、焙烧过程中主要反应的化学方程式为。(2)、滤渣1的主要成分出 外还有;氧化除杂工序中ZnO的作用是.若不通入氧气,其后果是。(3)、溶液中的 可用锌粉除去,还原除杂工序中反应的离子方程式为。(4)、电解硫酸锌溶液制备单质锌时,阴极的电极反应式为;沉积锌后的电解液可返回工序继续使用。
-