2018年高考化学真题分类汇编专题13:化学实验方案的设计与评价
试卷更新日期:2018-08-01 类型:二轮复习
一、单选题
-
1. 根据下列实验操作和现象所得出的结论正确的是( )
选项
实验操作和现象
结论
A
向苯酚浊液中滴加Na2CO3溶液,浊液变清
苯酚的酸性强于H2CO3的酸性
B
向碘水中加入等体积CCl4 , 振荡后静置,上层接近无色,下层显紫红色
I2在CCl4中的溶解度大于在水中的溶解度
C
向CuSO4溶液中加入铁粉,有红色固体析出
Fe2+的氧化性强于Cu2+的氧化性
D
向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成
Ksp(AgCl) >Ksp(AgI)
A、A B、B C、C D、D二、实验探究题
-
2. 某小组在实验室中探究金属钠与二氧化碳的反应。回答下列问题:(1)、选用如图所示装置及药品制取CO2。打开弹簧夹,制取CO2。为了得到干燥、纯净的CO2 , 产生的气流应依次通过盛有、的洗气瓶(填试剂名称)。反应结束后,关闭弹簧夹,可观察到的现象是。不能用稀硫酸代替稀盐酸,其原因是。
 (2)、金属钠与二氧化碳反应的实验步骤及现象如下表:
(2)、金属钠与二氧化碳反应的实验步骤及现象如下表:步骤
现象
将一小块金属钠在燃烧匙中点燃,迅速伸入盛有CO2的集气瓶中。充分反应,放置冷却
产生大量白烟,集气瓶底部有黑色固体产生,瓶壁上有白色物质产生
在集气瓶中加入适量蒸馏水,振荡、过滤
滤纸上留下黑色固体,滤液为无色溶液
①为检验集气瓶瓶壁上白色物质的成分,取适量滤液于2支试管中,向一支试管中滴加1滴酚酞溶液,溶液变红:向第二支试管中滴加澄清石灰水,溶液变浑浊。据此推断,白色物质的主要成分是(填标号)。
A.Na2O B.Na2O2 C.NaOH D.Na2CO3
②为检验黑色固体的成分,将其与浓硫酸反应,生成的气体具有刺激性气味。据此推断黑色固体是。
③本实验中金属钠与二氧化碳反应的化学方程式为。
3. 以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3 , 其主要实验流程如下:
已知:①Cl2+2OH−=ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)、步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为;实验中控制温度除用冰水浴外,还需采取的措施是。(2)、步骤Ⅱ合成N2H4·H2O的装置如题19图−1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是;使用冷凝管的目的是。 (3)、步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、 、 随pH的分布如题19图−2所示,Na2SO3的溶解度曲线如题19图−3所示)。
(3)、步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、 、 随pH的分布如题19图−2所示,Na2SO3的溶解度曲线如题19图−3所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: , 用少量无水乙醇洗涤,干燥,密封包装。
4. 烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:
Ⅰ.采样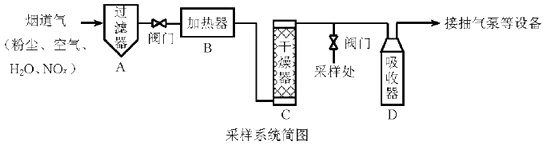
采样步骤:
①检验系统气密性;②加热器将烟道气加热至140℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。(1)、A中装有无碱玻璃棉,其作用是。(2)、C中填充的干燥剂是(填序号)。a.碱石灰
b.无水CuSO4
c.P2O5
(3)、用实验室常用仪器组装一套装置,其作用是与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂。 (4)、采样步骤②加热烟道气的目的是。(5)、Ⅱ.NOx含量的测定
(4)、采样步骤②加热烟道气的目的是。(5)、Ⅱ.NOx含量的测定将v L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3− , 加水稀释至100.00 mL。量取20.00 mL该溶液,加入v1 mL c1 mol·L−1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L−1 K2Cr2O7标准溶液滴定剩余的Fe2+ , 终点时消耗v2 mL。
NO被H2O2氧化为NO3−的离子方程式是。
(6)、滴定操作使用的玻璃仪器主要有。(7)、滴定过程中发生下列反应:3Fe2++NO3−+4H+=NO↑+3Fe3++2H2O
Cr2O72−+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O
则气样中NOx折合成NO2的含量为mg·m−3。
(8)、判断下列情况对NOx含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”)若缺少采样步骤③,会使测试结果。
若FeSO4标准溶液部分变质,会使测定结果。
5. 实验小组制备高铁酸钾(K2FeO4)并探究其性质。资料:K2FeO4为紫色固体,微溶于KOH溶液:具有强氧化性,在酸性或中性溶液中快速产生O₂,在碱性溶液中较稳定。
(1)、制备K2FeO4(夹持装置略)
①A为氯气发生装置。A中反应方程式是(锰被还原为Mn2+)。
②将除杂装置B补充完整并标明所用试剂 。
③C中得到紫色固体和溶液。C中Cl2发生的反应有3Cl2+2Fe(OH)3+10KOH=2K2FeO4+6KCl+8H2O,另外还有。
(2)、探究K2FeO4的性质①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有Cl2 , 为证明是否K2FeO4氧化了Cl-而产生Cl2 , 设计以下方案:

Ⅰ.由方案Ⅰ中溶液变红可知a中含有离子,但该离子的产生不能判断一定是K2FeO4将Cl-氧化,还可能由产生(用方程式表示)。
Ⅱ.方案Ⅱ可证明K2FeO4氧化了Cl- , 用KOH溶液洗涤的目的是。
②根据K2FeO4的制备实验得出:氧化性Cl₂ (填“>”或“<”),而方案Ⅱ实验表明,Cl2和 的氧化性强弱关系相反,原因是。
③资料表明,酸性溶液中的氧化性 >MnO4- , 验证实验如下:将溶液b滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象能否证明氧化性 > MnO4- , 若能,请说明理由;若不能,进一步设计实验方案。理由或方案:。
三、综合题
-
6. 硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol−1)可用作定影剂、还原剂。回答下列问题:(1)、已知:Ksp(BaSO4)=1.1×10−10 , Ksp(BaS2O3)=4.1×10−5。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤
现象
①取少量样品,加入除氧蒸馏水
②固体完全溶解得无色澄清溶液
③
④ , 有刺激性气体产生
⑤静置,
⑥
(2)、利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在中溶解,完全溶解后,全部转移至100 mL的中,加蒸馏水至。
②滴定:取0.00950 mol·L−1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72−+6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32−=S4O62−+2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液 , 即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为%(保留1位小数)。
7. NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。(1)、用水吸收NOx的相关热化学方程式如下:2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=−116.1 kJ·mol−1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol−1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=kJ·mol−1。
(2)、用稀硝酸吸收NOx , 得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:。(3)、用酸性(NH2)2CO水溶液吸收NOx , 吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:。(4)、在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见题20图−1)。
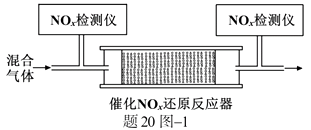
反应相同时间NOx的去除率随反应温度的变化曲线如题20图−2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是。
 8. 我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有 和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
8. 我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有 和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
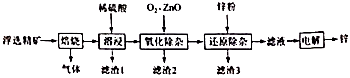
相关金属离子 形成氢氧化物沉淀的pH范围如下:
回答下列问题:金属离子 开始沉淀的pH 1.5 6.3 6.2 7.4 沉淀完全的pH 2.8 8.3 8.2 9.4 (1)、焙烧过程中主要反应的化学方程式为。(2)、滤渣1的主要成分出 外还有;氧化除杂工序中ZnO的作用是.若不通入氧气,其后果是。(3)、溶液中的 可用锌粉除去,还原除杂工序中反应的离子方程式为。(4)、电解硫酸锌溶液制备单质锌时,阴极的电极反应式为;沉积锌后的电解液可返回工序继续使用。9. 碱式硫酸铝溶液可用于烟气脱硫。室温下向一定浓度的硫酸铝溶液中加入一定量的碳酸钙粉末,反应后经过滤得到碱式硫酸铝溶液,反应方程式为(2−x)Al2(SO4)3+3xCaCO3+3xH2O=2[(1−x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
生成物(1−x)Al2(SO4)3·xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率。
(1)、制备碱式硫酸铝溶液时,维持反应温度和反应时间不变,提高x值的方法有。(2)、碱式硫酸铝溶液吸收SO2过程中,溶液的pH(填“增大”、“减小”、“不变”)。(3)、通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入0.1000 mol·L−1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L−1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1−x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。
-