2018年高考化学真题分类汇编专题12:物质的分离、提纯和检验
试卷更新日期:2018-08-01 类型:二轮复习
一、单选题
-
1. 下列分离方法正确的是( )A、回收水溶液中的I2 :加入乙酸,分液,蒸发 B、回收含有KCl的MnO2:加水溶解,过滤,干燥 C、除去氨气中的水蒸气:通过盛有P2O5的干燥管 D、除去乙醇中的水,加入无水氯化钙,蒸馏。2. 下列化合物中,能与Na2CO3溶液反应生成沉淀且沉淀可溶于NaOH溶液的是( )A、MgCl2 B、Ca(NO)3 C、FeSO4 D、AlCl33. 下列实验过程可以达到实验目的的是( )
编号 实验目的 实验过程 A 配制0.4000mol.L-1的溶液 称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容 B 探究维生素C的还原性 向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 C 制取并纯化氢气 向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液 D 探究浓度对反应速率的影响 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象 A、A B、B C、C D、D二、多选题
-
4. H2C2O4为二元弱酸,Ka1 (H2C2O4 ) =5.4×10−2 , Ka2 (H2C2O4 ) =5.4×10−5 , 设H2C2O4溶液中c(总)=c(H2C2O4) +c(HC2O4−) +c(C2O42−)。室温下用NaOH溶液滴定25.00 mL 0.1000 mol·L−1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )A、0.1000 mol·L−1 H2C2O4溶液:c(H+ ) =0.1000 mol·L−1+c(C2O42− )+c(OH−)−c(H2C2O4 ) B、c(Na+ ) =c(总)的溶液:c(Na+ ) >c(H2C2O4 ) >c(C2O42− ) >c(H+ ) C、pH = 7的溶液:c(Na+ ) =0.1000 mol·L−1+ c(C2O42−) −c(H2C2O4) D、c(Na+ ) =2c(总)的溶液:c(OH−) −c(H+) = 2c(H2C2O4) +c(HC2O4−)
三、实验探究题
-
5. 烟道气中的NOx是主要的大气污染物之一,为了监测其含量,选用如下采样和检测方法。回答下列问题:
Ⅰ.采样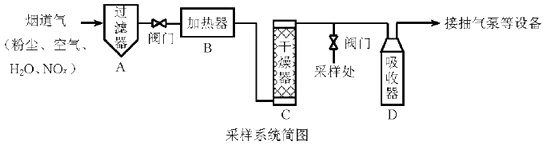
采样步骤:
①检验系统气密性;②加热器将烟道气加热至140℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。(1)、A中装有无碱玻璃棉,其作用是。(2)、C中填充的干燥剂是(填序号)。a.碱石灰
b.无水CuSO4
c.P2O5
(3)、用实验室常用仪器组装一套装置,其作用是与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂。 (4)、采样步骤②加热烟道气的目的是。(5)、Ⅱ.NOx含量的测定
(4)、采样步骤②加热烟道气的目的是。(5)、Ⅱ.NOx含量的测定将v L气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3− , 加水稀释至100.00 mL。量取20.00 mL该溶液,加入v1 mL c1 mol·L−1 FeSO4标准溶液(过量),充分反应后,用c2 mol·L−1 K2Cr2O7标准溶液滴定剩余的Fe2+ , 终点时消耗v2 mL。
NO被H2O2氧化为NO3−的离子方程式是。
(6)、滴定操作使用的玻璃仪器主要有。(7)、滴定过程中发生下列反应:3Fe2++NO3−+4H+=NO↑+3Fe3++2H2O
Cr2O72−+ 6Fe2+ +14H+ =2Cr3+ +6Fe3++7H2O
则气样中NOx折合成NO2的含量为mg·m−3。
(8)、判断下列情况对NOx含量测定结果的影响(填“偏高” 、“偏低”或“无影响 ”)若缺少采样步骤③,会使测试结果。
若FeSO4标准溶液部分变质,会使测定结果。
6. 3,4−亚甲二氧基苯甲酸是一种用途广泛的有机合成中间体,微溶于水,实验室可用KMnO4氧化3,4−亚甲二氧基苯甲醛制备,其反应方程式为
实验步骤如下:
步骤1:向反应瓶中加入3,4−亚甲二氧基苯甲醛和水,快速搅拌,于70~80 ℃滴加KMnO4溶液。反应结束后,加入KOH溶液至碱性。
步骤2:趁热过滤,洗涤滤饼,合并滤液和洗涤液。
步骤3:对合并后的溶液进行处理。
步骤4:抽滤,洗涤,干燥,得3,4−亚甲二氧基苯甲酸固体。
(1)、步骤1中,反应结束后,若观察到反应液呈紫红色,需向溶液中滴加NaHSO3溶液, 转化为(填化学式);加入KOH溶液至碱性的目的是。(2)、步骤2中,趁热过滤除去的物质是(填化学式)。(3)、步骤3中,处理合并后溶液的实验操作为。(4)、步骤4中,抽滤所用的装置包括、吸滤瓶、安全瓶和抽气泵。四、综合题
-
7. 硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol−1)可用作定影剂、还原剂。回答下列问题:(1)、已知:Ksp(BaSO4)=1.1×10−10 , Ksp(BaS2O3)=4.1×10−5。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤
现象
①取少量样品,加入除氧蒸馏水
②固体完全溶解得无色澄清溶液
③
④ , 有刺激性气体产生
⑤静置,
⑥
(2)、利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在中溶解,完全溶解后,全部转移至100 mL的中,加蒸馏水至。
②滴定:取0.00950 mol·L−1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72−+6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32−=S4O62−+2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液 , 即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为%(保留1位小数)。
-