2018年高考化学真题分类汇编专题04:物质结构
试卷更新日期:2018-08-01 类型:二轮复习
一、综合题
-
1. 臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为 和 ,NOx也可在其他条件下被还原为N2。(1)、 中心原子轨道的杂化类型为; 的空间构型为(用文字描述)。(2)、Fe2+基态核外电子排布式为。(3)、与O3分子互为等电子体的一种阴离子为(填化学式)。(4)、N2分子中σ键与π键的数目比n(σ)∶n(π)=。(5)、[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。
 2. 硫及其化合物有许多用途,相关物质的物理常数如下表所示:
2. 硫及其化合物有许多用途,相关物质的物理常数如下表所示:H2S
S
FeS2
SO2
SO3
H2SO4
熔点/℃
-85.5
115.2
>600(分解)
-75.5
16.8
10.3
沸点/℃
-60.3
444.6
-10.0
45.0
337.0
回答下列问题:
(1)、基态Fe原子价层电子的电子排布图(轨道表达式)为 , 基态S原子电子占据最高能级的电子云轮廓图为 形。(2)、根据价层电子对互斥理论,H2S,SO2 , SO3的气态分子中,中心原子价层电子对数不同于其他分子的是。(3)、图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为。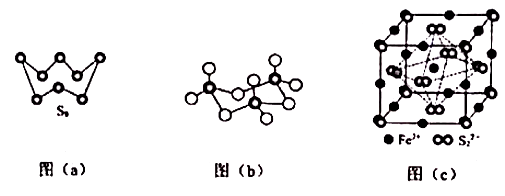 (4)、气态三氧化硫以单分子形式存在,其分子的立体构型为形,其中共价键的类型有种;固体三氧化硫中存在如图(b)所示的三氯分子。该分子中S原子的杂化轨道类型为。(5)、FeS2晶体的晶胞如图(c)所示,晶胞边长为a nm,FeS2相对式量为M、阿伏加德罗常数的值为NA , 其晶体密度的计算表达式为 ;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为 nm3. [化学——选修3:物质结构与性质]
(4)、气态三氧化硫以单分子形式存在,其分子的立体构型为形,其中共价键的类型有种;固体三氧化硫中存在如图(b)所示的三氯分子。该分子中S原子的杂化轨道类型为。(5)、FeS2晶体的晶胞如图(c)所示,晶胞边长为a nm,FeS2相对式量为M、阿伏加德罗常数的值为NA , 其晶体密度的计算表达式为 ;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为 nm3. [化学——选修3:物质结构与性质]锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)、Zn原子核外电子排布式为。(2)、黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)Ⅰ1(Cu)(填“大于”或“小于”)。原因是。(3)、ZnF2具有较高的熔点(872 ℃),其化学键类型是;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是。(4)、《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为 , C原子的杂化形式为。(5)、金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA , Zn的密度为g·cm-3(列出计算式)。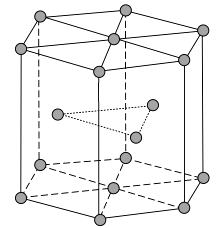 4. Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻,能量密度大等优良性能,得到广泛应用,回答下列问题:(1)、下列Li原子电子排布图表示的状态中,能量最低和最高的分别为、。(填标号)
4. Li是最轻的固体金属,采用Li作为负极材料的电池具有小而轻,能量密度大等优良性能,得到广泛应用,回答下列问题:(1)、下列Li原子电子排布图表示的状态中,能量最低和最高的分别为、。(填标号)A.

B.
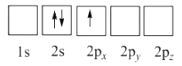
C.

D.
 (2)、Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是。(3)、LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是。中心原子的杂化形式为 , LiAlH4中,存在(填标号)。
(2)、Li+与H-具有相同的电子构型,r(Li+)小于r(H-),原因是。(3)、LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是。中心原子的杂化形式为 , LiAlH4中,存在(填标号)。A.离子键
B.σ键
C.π键
D.氢键
(4)、Li2O是离子晶体,其晶格能可通过图(a)的 Born-Haber循环计算得到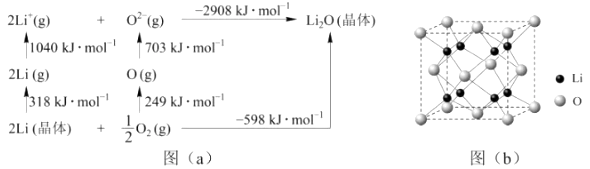
可知,Li原子的第一电离能为kJ·mol-1 , O=O键键能为kJ·mol-1 , Li2O晶格能为kJ·mol-1(5)、Li2O具有反莹石结构,晶胞如图(b)所示。已知晶胞参数为0.4665mm,阿伏加德罗常数的值为NA , 则Li2O的密度为 g/cm3(列出计算式)。