2018年江苏省连云港市中考化学试题
试卷更新日期:2018-07-24 类型:中考真卷
一、选择题
-
1. 每年的5月31日是“世界无烟日”。下列说法错误的是( )A、吸烟损害大脑,使人记忆力减退 B、长期吸烟易患肺气肿、肺癌等疾病 C、吸烟有害健康,但“二手烟”对人体无害 D、香烟烟气中的CO、尼古丁等对人体危害很大2. 下列过程中包含化学变化的是( )A、酒精挥发 B、冰雪融化 C、干冰升华 D、金属氧化3. 下列图示实验操作中,正确的是( )A、
 B、
B、 C、
C、 D、
D、 4. 下列化学用语表示正确的是( )A、3个铁离子:3Fe2+ B、1个臭氧分子:O3 C、锰酸钾的化学式:KMnO4 D、氟离子的结构示意图:
4. 下列化学用语表示正确的是( )A、3个铁离子:3Fe2+ B、1个臭氧分子:O3 C、锰酸钾的化学式:KMnO4 D、氟离子的结构示意图: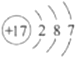 5. 下列几种物质中,其重要成分不属于人体所需基本营养素的是( )A、白糖 B、白面 C、白酒 D、白开水6. 下列有关物质的性质与用途具有对应关系的是( )A、铬耐磨、耐腐蚀,可镀在钢铁制品表面防生锈 B、石墨很软,有光泽和滑腻感,可用于制作电极 C、乙醇易挥发、易溶于水,可掺入汽油中作燃料 D、聚四氟乙烯塑料密度小,可用作不粘锅的内衬7. 已知:金属X在常温下能与空气中的氧气反应,而金属Y和Z不能;将Y、Z分别投入稀盐酸中,Y溶解并产生气泡,Z无变化。下列说法正确的是( )A、X氧化物的化学式只能表示为XO B、Y能将X从它的盐溶液中置换出来 C、Z在自然界中只能以单质形式存在 D、三种金属的活动性顺序:X>Y>Z8. 下列排序正确的是( )A、空气中物质的含量: B、溶液的pH: C、氮元素的化合价: D、硫元素的质量分数:9. 物质a和b在一定条件下反应生成e和d的微观示意图如下:
5. 下列几种物质中,其重要成分不属于人体所需基本营养素的是( )A、白糖 B、白面 C、白酒 D、白开水6. 下列有关物质的性质与用途具有对应关系的是( )A、铬耐磨、耐腐蚀,可镀在钢铁制品表面防生锈 B、石墨很软,有光泽和滑腻感,可用于制作电极 C、乙醇易挥发、易溶于水,可掺入汽油中作燃料 D、聚四氟乙烯塑料密度小,可用作不粘锅的内衬7. 已知:金属X在常温下能与空气中的氧气反应,而金属Y和Z不能;将Y、Z分别投入稀盐酸中,Y溶解并产生气泡,Z无变化。下列说法正确的是( )A、X氧化物的化学式只能表示为XO B、Y能将X从它的盐溶液中置换出来 C、Z在自然界中只能以单质形式存在 D、三种金属的活动性顺序:X>Y>Z8. 下列排序正确的是( )A、空气中物质的含量: B、溶液的pH: C、氮元素的化合价: D、硫元素的质量分数:9. 物质a和b在一定条件下反应生成e和d的微观示意图如下:
下列说法正确的是( )
A、物质c是一氧化碳 B、该反应不符合质量守恒定律 C、该反应前后,原子的种类发生改变 D、该反应前后,分子的个数保持不变10. 下列各组实验方案中,不能达到实验目的的是( )选项
实验目的
实验方案
A
稀释浓硫酸
将浓硫酸缓慢注入水中,并不断搅拌
B
除去CO2气体中的HCl
将气体通过盛有足量NaOH溶液的洗气瓶
C
鉴别化肥KNO3和NH4NO3
取样,加Ca(OH)2固体混合研磨,闻气味
D
除去FeCl2溶液中的CuCl2
加入过量的Fe粉,充分反应后过滤
A、A B、B C、C D、D11. 甲、乙、丙三种固体物质的溶解度曲线如右图所示。下列说法错误的是( ) A、T2℃时,取等质量的甲、乙分别配制成饱和溶液,所需水的质量:甲>乙 B、T2℃时,将甲、乙的饱和溶液均降温到T1℃,得到的溶液仍饱和 C、若甲中混有少量的丙,可采用降温结晶的方法提纯甲 D、T2℃时,甲、乙各30g分别加入100g水中,均形成饱和溶液12. 甲、乙、丙、X、Y、Z六种物质间只通过一步反应就能实现右图中箭头所示的转化。不符合上述要求的一组物质是( )
A、T2℃时,取等质量的甲、乙分别配制成饱和溶液,所需水的质量:甲>乙 B、T2℃时,将甲、乙的饱和溶液均降温到T1℃,得到的溶液仍饱和 C、若甲中混有少量的丙,可采用降温结晶的方法提纯甲 D、T2℃时,甲、乙各30g分别加入100g水中,均形成饱和溶液12. 甲、乙、丙、X、Y、Z六种物质间只通过一步反应就能实现右图中箭头所示的转化。不符合上述要求的一组物质是( )
选项
甲
X
A
O2
H2O
B
CO2
CaCO3
C
Fe
Fe3O4
D
NaOH
NaNO3
A、A B、B C、C D、D二、非选择题
-
13. 坚持“人与自然和谐共生”是新时代中国特色社会主义的基本方略之一,让“山更绿,水更清,空气更清新”是我们共同的追求。(1)、“山更绿”离不开绿色植物。
①植物的光合作用需要吸收空气中的水和 , 可有效减缓温室效应。
②酸雨不利于植物生长。煤燃烧产生的进入大气后可形成“硫酸型”酸雨。
(2)、“水更清”就得保护好水资源。①下列关于水的说法正确的是 (填字母)。
a.工业废水需经处理达标后才可排放
b.为保护好水资源,禁止使用化肥和农药
c.天然水只要通过处理后变清即可饮用
d.为了改善水质,可向其中加入大量的净水剂和消毒剂
②“赤潮”或“水华”主要是由于水中某些营养元素含量过高,导致藻类大量繁殖,鱼类等死亡。这里的营养元素主要指 (写出一种即可)。
(3)、“空气更清新”需要监测防治大气污染。①目前未计入空气污染指数监测项目的有 (填字母)。
a.一氧化碳
b.二氧化氮
c.可吸入颗粒物
d.稀有气体
②硝酸工厂排放的尾气中常含有NO、NO2等有害气体,可用氢氧化钠溶液来吸收:NO+NO2 +2NaOH=2X+H2O。 X的化学式为。
14.(1)、炒菜时油锅着火可用锅盖盖灭,其灭火原理是。(2)、家用液化气的主要成分之一是丙烷(C3H8),丙烷属于 (填字母)。a.氧化物
b.化合物
c.无机物
d.有机物
(3)、热水壶中水垢的主要成分是CaCO3和 (填化学式), 可用食醋洗涤。食醋的重要成分是醋酸(设其化学式为HA),写出其与CaCO3反应的化学方程式:。(4)、利用厨房中的物品鉴別食盐和苏打:取一固体于碗中,加入(填物质名称),若有 , 则该固体为苏打;若无此现象,则为食盐。15. 过氧化钙( CaO2)是用途广泛的优良供氧剂。以电石渣[主要成分为Ca(OH)2 , 含少量CaCO3为原料制备CaO2的一种工艺流程如下:
【查阅资料】I. Ca(OH)2+2NH4Cl=CaCl2+2NH3·H2O
Ⅱ.CaCl2+2NH3·H2O+H2O2 +6H2O= CaO2·8H2O↓+ 2NH4Cl
Ⅲ. CaO2·8H2O在水中不太稳定,会缓慢分解。
(1)、“提取Ca(OH)2”时反应的基本类型是;Ca(OH)2的俗名为;“过滤1”所得滤渣的主要成分是。(2)、在实验室进行过滤操作时,要遵循“一贴、二低、三靠”原则。其中“二低”指的是:滤纸边缘略低于漏斗口、。生产过程中为了精确测定溶液的pH,常使用 (填仪器名称)。(3)、在其他条件不变的情况下,制备CaO2·8H2O的反应时间(t)对其产率(w)的影响如图所示。
①平均反应速率最快的时间段为: (填字母)。
a. 0~10min
b. 10~20min
c. 20~30min
d.30~40min
②30min后,w开始下降的主要原因是。
(4)、为了测定加入的NH4Cl溶液中溶质的质量分数,取30.00g NH4Cl溶液于烧杯中,加入稍过量的AgNO3溶液,完全反应后过滤、洗涤、干燥、称量,得到14.35g 白色固体。通过计算确定该溶液中NH4Cl的质量分数(精确到0.1%)。16. 水是由氢、氧两种元素组成的化合物。这一结论是科学家们在大量实险的基础上得出的。(1)、实验室中常用锌粒和稀硫酸反应来制备氢气。请从下列装置中选择并组装一套制取干燥氢气的装置,正确的连接顺序为 (用接口处字母填写)。 (2)、研究氢气的燃烧实验是人们认识水组成的开始。
(2)、研究氢气的燃烧实验是人们认识水组成的开始。①氢气在点燃前一定要。
②氢气在空气中燃烧时,若在火焰上方罩一冷而干燥的小烧杯,可观察到的现象是。在相同条件下,欲使1L氢气完全燃烧,所需空气至少约为L。
(3)、科学家们又用“电解法”证明了水的组成(装置如图所示,电极不与水及生成的气体反应)。
电解时,水中需加入少量的NaOH,其作用是。 通电一段时间后,发现甲、乙两量筒中收集的气体体积比略小于1:2,其原因可能是 (写出一条即可)。
(4)、拉瓦锡还用另一实验证明了水的组成。他让水蒸气通过一根烧红的铁质枪管,结果得到了氧气,同时枪管表面有黑色固体(磁铁矿的主要成分)生成。该反应的化学方程式为。
(5)、用“氢气还原氧化铜”实验也可以证明水的组成。
装置A中的玻璃管和其中物质在反应前后的质量差为m1 , 装置B和其中物质在反应前后的质量差为m2 , 据此可计算出水中O、H元素的质量比为(用含 m1、m2的代数式表示)。实验时该比值往往略小于8:1,原因可能是(写出一条即可)。