2016-2017学年山东省济南市平阴一中高三上学期期中化学试卷
试卷更新日期:2017-02-07 类型:期中考试
一、选择题
-
1. 下列物质与其用途完全符合的是( )
①Na2O2﹣供氧剂
②晶体Si﹣太阳能电池
③AgI﹣人工降雨
④NaCl﹣制纯碱
⑤Al2O3﹣焊接钢轨
⑥NaClO﹣消毒剂
⑦Fe2O3﹣红色油漆或涂料
⑧SO2﹣食品防腐剂
⑨NH3﹣制冷剂
⑩水玻璃﹣耐火材料.
A、①④⑤⑧⑨ B、①②③⑥⑦⑨ C、①②③④⑥⑦⑨⑩ D、①②③④⑥⑦⑨2. 下列有关Cl、N,S等非金属元素化合物的说法正确的是( )A、漂粉精的主要成分为次氯酸钙 B、实验室可用浓硫酸干燥氨气 C、实验室可用NaOH溶液处理NO2、HCl废气 D、Al2(SO4)3可除去碱性废水及酸性废水中的悬浮颗粒3. 设NA为阿伏加德罗常数值.下列有关叙述正确的是( )A、14 g乙烯和丙烯混合气体中的氢原子数为2NA B、1 molN2与4 mol H2反应生成的NH3分子数为2NA C、1 molFe溶于过量硝酸,电子转移数为2NA D、标准状况下,2.24 LCCl4含有的共价键数为0.4NA4. 氰氨基化钙是一种重要的化工原料,其制备的化学方程式为:CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是( )A、HCN既是氧化剂又是还原剂 B、CaCN2中含有非极性键 C、CO为氧化产物,H2为还原产物 D、每消耗5g CaCO3生成1.12L CO25. 铝土矿的主要成分中含有氧化铝、氧化铁和二氧化硅等,工业上经过下列工艺可以冶炼金属铝.下列说法错误的是( ) A、①、②中除加试剂外,还需要进行过滤操作 B、a、b中铝元素的化合价相同 C、③中需要通入过量的氨气 D、④进行的操作是加热,而且d一定是氧化铝6. 短周期四种元素离子W2+、X﹣、Y2﹣、Z+的电子层结构相同.下列说法正确的是( )A、原子序数:W>Z>X>Y B、离子半径:r(W2+)>r(X﹣)>r(Y2﹣)>r(Z+) C、Y的气态氢化物比X的气态氢化物稳定 D、氢氧化物碱性强弱:W(OH)2>ZOH7. 能正确表示下列反应的离子方程式为( )A、向明矾(KAl(SO4)2•12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42﹣沉淀完全:2Al3++3SO42﹣+3Ba2++6OH﹣═2Al(OH)3↓+3BaSO4↓ B、Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O C、玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH﹣=Na2SiO3↓+H2O D、VO2+与酸性高锰酸钾溶液反应:5VO2++MnO4﹣+H2O═5VO2++Mn2++2H+8. 下列示意图与对应的反应情况符合的是( )A、
A、①、②中除加试剂外,还需要进行过滤操作 B、a、b中铝元素的化合价相同 C、③中需要通入过量的氨气 D、④进行的操作是加热,而且d一定是氧化铝6. 短周期四种元素离子W2+、X﹣、Y2﹣、Z+的电子层结构相同.下列说法正确的是( )A、原子序数:W>Z>X>Y B、离子半径:r(W2+)>r(X﹣)>r(Y2﹣)>r(Z+) C、Y的气态氢化物比X的气态氢化物稳定 D、氢氧化物碱性强弱:W(OH)2>ZOH7. 能正确表示下列反应的离子方程式为( )A、向明矾(KAl(SO4)2•12H2O)溶液中滴加Ba(OH)2溶液,恰好使SO42﹣沉淀完全:2Al3++3SO42﹣+3Ba2++6OH﹣═2Al(OH)3↓+3BaSO4↓ B、Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O C、玻璃试剂瓶被烧碱溶液腐蚀:SiO2+2Na++2OH﹣=Na2SiO3↓+H2O D、VO2+与酸性高锰酸钾溶液反应:5VO2++MnO4﹣+H2O═5VO2++Mn2++2H+8. 下列示意图与对应的反应情况符合的是( )A、 向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2至过量
B、
向含0.01mol KOH和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2至过量
B、 向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
C、
向NaHSO4溶液中逐滴加入Ba(OH)2溶液至过量
C、 向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量
D、
向KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液至过量
D、 向NaAlO2溶液中逐滴加入盐酸至过量
9. 常温下,甲组中的某种物质能与乙组中的所有物质发生反应,甲组中的该物质是( )
向NaAlO2溶液中逐滴加入盐酸至过量
9. 常温下,甲组中的某种物质能与乙组中的所有物质发生反应,甲组中的该物质是( )甲组
①Al(OH)3 ②SiO2 ③FeCl3溶液 ④SO2
乙组
a.NaOH溶液 b.浓HNO3 c.氨水 d.氯水 e.H2O2溶液
A、① B、② C、③ D、④10. 室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体充分接触(如图),容器内的压强由大到小的顺序是( )编号
①
②
③
④
气体M
H2S
NH3
HI
NO
气体N
SO2
HCl
Cl2
O2
 A、③=④>①>② B、③>④>①>② C、④>③>②>① D、④>③>①>②11. 某溶液中含有两种溶质NaCl和H2SO4 , 它们的物质的量之比为3:1.滴入几滴石蕊溶液后,用石墨作电极电解该混合溶液,根据电极产物,电解过程可明显分为三个阶段.下列叙述中,不正确的是( )A、阴极自始至终只产生H2 B、电解过程中,溶液颜色呈现红色→紫色→蓝色的变化 C、电解过程中,Na+和SO42﹣的物质的量浓度保持不变 D、第一阶段中阴、阳两极产生的气体混合引燃后,恰好完全反应得到HCl12. 根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
A、③=④>①>② B、③>④>①>② C、④>③>②>① D、④>③>①>②11. 某溶液中含有两种溶质NaCl和H2SO4 , 它们的物质的量之比为3:1.滴入几滴石蕊溶液后,用石墨作电极电解该混合溶液,根据电极产物,电解过程可明显分为三个阶段.下列叙述中,不正确的是( )A、阴极自始至终只产生H2 B、电解过程中,溶液颜色呈现红色→紫色→蓝色的变化 C、电解过程中,Na+和SO42﹣的物质的量浓度保持不变 D、第一阶段中阴、阳两极产生的气体混合引燃后,恰好完全反应得到HCl12. 根据如图的转化关系判断下列说法正确的是(反应条件已略去)( ) A、反应①②③④⑤均属于氧化反应和离子反应 B、反应⑤说明该条件下铝的还原性强于锰 C、相同条件下生成等量的O2 , 反应③和④转移的电子数之比为1:1 D、反应①中氧化剂与还原剂的物质的量之比为1:413. 根据表中信息判断,下列选项不正确的是( )
A、反应①②③④⑤均属于氧化反应和离子反应 B、反应⑤说明该条件下铝的还原性强于锰 C、相同条件下生成等量的O2 , 反应③和④转移的电子数之比为1:1 D、反应①中氧化剂与还原剂的物质的量之比为1:413. 根据表中信息判断,下列选项不正确的是( )序列
参加反应的物质
生成物
①
MnO4﹣ …
Cl2、Mn2+ …
②
Cl2、FeBr2
FeCl3、FeBr3
③
KMnO4、H2O2、H2SO4
K2SO4、MnSO4 …
A、第①组反应中生成0.5mol Cl2 , 转移电子1mol B、第②组反应中Cl2与 FeBr2的物质的量之比为1:2 C、第③组反应的其余产物为H2O和 O2 D、氧化性由强到弱顺序为MnO4﹣>Cl2>Fe3+>Br214. 短周期元素A,B,C,D的原子序数依次增大,A原子在元素周期表中原子半径最小,B原子最外层电子数是电子层数的3倍,D与B属于同一主族,CA2是一种储氢材料.下列叙述正确的是( )A、元素B的单质与化合物A2D反应能生成D的单质 B、工业上利用铝热反应可制得单质C C、原子B,C,D半径的大小顺序:D>C>B D、一定条件下,过量的B单质与D单质直接生成BD315. 如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是( ) A、若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色 B、若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 C、若A为浓盐酸,B为MnO2 , C中盛品红溶液,则C中溶液不褪色 D、若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀16. 三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )
A、若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色 B、若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 C、若A为浓盐酸,B为MnO2 , C中盛品红溶液,则C中溶液不褪色 D、若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀16. 三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42﹣可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室.下列叙述正确的是( )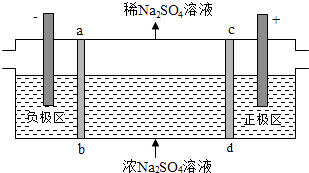 A、通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大 B、该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 C、负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低 D、当电路中通过1mol电子的电量时,会有0.5mol的O2生成
A、通电后中间隔室的SO42﹣离子向正极迁移,正极区溶液pH增大 B、该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品 C、负极反应为2H2O﹣4e﹣=O2+4H+ , 负极区溶液pH降低 D、当电路中通过1mol电子的电量时,会有0.5mol的O2生成二、非选择题
-
17. X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
X
Y
Z
W
请回答下列问题:
(1)、W元素在周期表中的位置(2)、X、Y、Z、W分别形成的简单离子的半径由小到大的顺序为<<<(用化学式填写,下同);Y、Z对应的气态氢化物的稳定性> .(3)、在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡时有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式为 .(4)、工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2 , 该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式 .18. 某强酸性溶液X,可能含有Al3+、Ba2+、NH4+、Fe2+、Fe3+、CO32﹣、SO42﹣、SiO32﹣、NO3﹣中的一种或几种离子,取该溶液进行实验,其现象及转化如图.反应过程中有一种气体是红棕色.
请回答下列问题:
(1)、产生气体A的离子方程式为;(2)、若转化③中,D、H2O、O2三种物质恰好发生化合反应生成E,则反应中D与O2的物质的量之比为;(3)、转化⑦中的离子方程式为;(4)、溶液X中,关于NO3﹣的判断一定正确的是a.一定有 b.一定没有 c.可能有.
19. 铜、铁、铝是重要的金属材料,铜、铁、铝及其化合物有非常重要的用途.(1)、工业上可用Cu2S和O2反应制取粗铜,该反应中氧化剂为 . 电解粗铜制取精铜,电解时,阳极材料是 .(2)、铁元素与氯元素可形成FeCl2和FeCl3两种化合物,下列说法正确的是 (填序号).①保存FeCl2溶液时,需向溶液中加入少量Fe
②FeCl2只能通过置换反应生成,FeCl3只能通过化合反应生成
③铜片、碳棒和FeCl3溶液组成原电池,电子由铜片沿导线流向碳棒
④向淀粉﹣碘化钾溶液中滴加几滴FeCl2的浓溶液,原无色溶液变为蓝色
⑤纯铁与稀盐酸反应产生氢气的速率较慢;再加入少量CuCl2•2H2O晶体,速率加快
(3)、高铁酸钾(K2FeO4)是一种高效多功能水处理剂.K2FeO4可以铁为电极,通过电解浓的KOH溶液来制取,写出电解法制取K2FeO4的阳极反应式:(4)、工业上常用铝土矿(含SiO2等杂质)生产铝.从Na2SiO3和NaAlO2混合溶液中制得Al(OH)3 , 需要从下列试剂中选择两种,选用的试剂组合最好是 .a.NaOH溶液 b.氨水 c.CO2 d.盐酸
(5)、四氢铝锂(LiAlH4)是有机合成中重要的还原剂,溶解于NaOH溶液时产生一种无色气体,请完成并配平该反应的离子方程式.LiAlH4+=++ .
20. 亚硝酸钠(NaNO2)是一种常见的食品添加剂,使用时必须严格控制其用量.某兴趣小组用下图所示装置制备NaNO2并对其性质作如下探究(A中加热装置已略去).
已知:①2NO+Na2O2═2NaNO2;
②NO能被酸性KMnO4氧化成NO3﹣ , MnO4﹣被还原为Mn2+ .
(1)、制备NaNO2(i)装置A三颈烧瓶中发生反应的化学方程式为 .
(ii)B装置的目的是 .
(iii)为保证制得的亚硝酸钠的纯度,C装置中盛放的试剂可能是(填序号).
A.P2O5 B.碱石灰 C.无水CaCl2 D.生石灰
(iv)E装置发生反应的离子方程式是 .
(2)、测定NaNO2纯度准确称取质量为m g的NaNO2样品放入锥形瓶中,加适量水溶解.用a mol•L﹣1酸性KMnO4溶液滴定,达滴定终点时所用KMnO4溶液体积为bmL.则样品中NaNO2的质量分数为 .
(假设样品中其他杂质与酸性KMnO4溶液不反应,用含m、a、b的代数式表示.)
21. 硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质.用硼泥生产氢氧化镁的工艺流程如图所示:
已知某些氢氧化物沉淀的pH如下表所示:
氢氧化物
开始沉淀时的pH
完全沉淀时的pH
Mg(OH)2
9.3
10.8
Fe(OH)2
7.6
9.6
Fe(OH)3
Al(OH)3
2.7
3.7
3.7
4.7
(1)、MgO的电子式为 .(2)、滤渣2的主要成分是 , 向滤渣2中继续加入过量的NaOH溶液,发生反应的离子方程式为 .(3)、加入NaOH调节溶液pH=12.0时,发生反应的离子方程式为 .(4)、利用Mg(OH)2与含SO2的烟气反应生成MgSO4 , 可以使烟气脱硫,该反应的化学方程式为 .(5)、若取a吨硼泥为原料,最后得到b吨Mg(OH)产品(假设生产过程中镁元素无损失),则硼泥中MgO的质量分数为(用含有a、b的代数式表示).