浙教版八年级科学上册同步练习之 1.5 物质的溶解
试卷更新日期:2018-07-18 类型:同步测试
一、单选题
-
1. 将相同质量的甲、乙两种不同溶质的溶液同时蒸发掉10g水,并冷却到T℃时,分别析出2g甲和3g乙物质(均不带结晶水),则下列说法正确的是( )A、T℃时,甲、乙两种物质的溶解度可能相同 B、T℃时,甲物质的溶解度一定大于乙 C、T℃时,甲物质的溶解度一定小于乙 D、将析出晶体后的甲、乙两种饱和溶液混合后(甲、乙不反应),溶液仍饱和2. 某同学做“比较蔗糖和食盐在水中的溶解能力”的实验,他对实验提出的下列要求中,多余的是( )A、取质量相同的蔗糖和食盐 B、取质量相同的两杯水 C、蔗糖和食盐放入水中后都不能进行搅拌 D、两杯水的温度应当相同3. 下表是固体甲和乙在不同温度时的溶解度,下列说法中正确的是( )
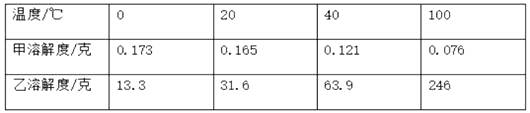
A、20℃时物质的溶解能力大小关系:甲大于乙 B、20℃时100克乙物质加入100克水中,所得溶液的质量是200克 C、100℃时乙物质的饱和溶液冷却到室温会析出晶体后,溶液仍为饱和溶液 D、20℃时甲物质的饱和溶液升高温度会变为不饱和溶液4. 某物质(仅含一种溶质)的溶液在t℃时,恒温蒸发掉10 g水,析出了2g晶体,再恒温蒸发掉10 g水,又析出了3g晶体,则下列说法正确的是( )A、原溶液在t℃时一定是不饱和溶液 B、原溶液一定是稀溶液 C、最后剩余的溶液一定比原溶液稀 D、最后剩余溶液的溶质质量分数比原溶液的溶质质量分数小5. 关于溶液下列说法正确的是( )A、饱和溶液一定是浓溶液 B、t℃时,100克某物质的饱和溶液中含该溶质18克,则该物质在t℃时溶解度是18克 C、饱和溶液指一定温度下一定量溶剂中不能继续溶解某种溶质的溶液 D、不饱和溶液加溶剂可以变为饱和溶液6. 如图为氯化铵和硫酸钠的溶解度曲线,下列说法错误的是( )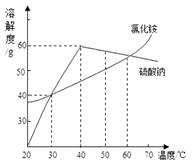 A、30℃时,氯化铵、硫酸钠的溶解度相等 B、氯化铵的溶解度随温度的升高而增大 C、将60℃的硫酸钠饱和溶液降温至40℃,有晶体析出 D、在30℃~70℃范围内,硫酸钠饱和溶液在40℃时溶质的质量分数最大7. 在温度不变时,某固态物质的溶液X经如下变化:蒸发5g水,无晶体析出,得到Y溶液;把Y溶液蒸发5g水,析出2g晶体,过滤,得到Z溶液。下列结论不正确的是( )A、Y溶液不一定是饱和溶液 B、Z溶液一定是饱和溶 C、Y和Z溶液中溶质的质量分数可能相等 D、将Z溶液再蒸发5g水,析出晶体的质量一定是2g8. 已知硝酸钾在不同温度下的溶解度如下表,下列说法错误的是( )
A、30℃时,氯化铵、硫酸钠的溶解度相等 B、氯化铵的溶解度随温度的升高而增大 C、将60℃的硫酸钠饱和溶液降温至40℃,有晶体析出 D、在30℃~70℃范围内,硫酸钠饱和溶液在40℃时溶质的质量分数最大7. 在温度不变时,某固态物质的溶液X经如下变化:蒸发5g水,无晶体析出,得到Y溶液;把Y溶液蒸发5g水,析出2g晶体,过滤,得到Z溶液。下列结论不正确的是( )A、Y溶液不一定是饱和溶液 B、Z溶液一定是饱和溶 C、Y和Z溶液中溶质的质量分数可能相等 D、将Z溶液再蒸发5g水,析出晶体的质量一定是2g8. 已知硝酸钾在不同温度下的溶解度如下表,下列说法错误的是( )温度/℃
0
10
20
30
40
50
溶解度/g
13.3
20.9
31.6
45.8
63.9
85.5
A、20℃时,饱和硝酸钾溶液的质量分数为31.6% B、硝酸钾的溶解度随着温度升高而增大 C、30℃时,145.8g硝酸钾饱和溶液中含有45.8g溶质 D、将40℃的硝酸钾溶液降温至20℃,不一定有晶体析出9. 实验室配制50g溶质质量分数为15%的氯化钠溶液。下列说法中错误的是( )A、实验的步骤为计算、称量、溶解 B、溶解过程中玻璃棒的作用是搅拌,以加快氯化钠的溶解速率 C、把配制好的氯化钠溶液倒入刚用蒸馏水润洗过的试剂瓶中,并贴上标签 D、量取水时,用规格为50mL的量筒量取42.5mL蒸馏水10. 20℃时,NaCl溶解于水的实验数据如下表。则下列叙述正确的是( )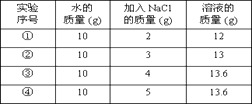 A、②中所得溶液是饱和溶液 B、20℃时10g水最多能溶解4g NaCl C、③④溶液的溶质质量分数相等 D、①所得溶液的溶质质量分数为20%11. 如图所示为配制50g溶质质量分数为 10%的氯化钠溶液的操作过程,下列有关操作与目的分析均正确的是( )
A、②中所得溶液是饱和溶液 B、20℃时10g水最多能溶解4g NaCl C、③④溶液的溶质质量分数相等 D、①所得溶液的溶质质量分数为20%11. 如图所示为配制50g溶质质量分数为 10%的氯化钠溶液的操作过程,下列有关操作与目的分析均正确的是( )
选项
操作
目的
A
用剩的食盐放回原试剂瓶
避免浪费
B
天平调平后在左、右托盘各垫一张相同的纸
保证称取的食盐质量更准确
C
用50mL量筒替代天平量取所需的水
更加简便
D
溶解时用玻璃棒搅拌
增加食盐的溶解能力
A、A B、B C、C D、D12. 某同学要配制一定浓度的氯化钠溶液,将天平调到平衡后,该同学将氯化钠晶体放在右盘,砝码放在天平的左盘。当天平重新平衡后,左盘砝码为 3 克,游码在 0.5 克处。该同学将称得的氯化钠晶体溶解于水配成 10 克溶液,则该溶液的质量分数是( )A、35% B、30% C、25% D、20%13. 饱和食盐水在室温下放置一段时间,有少量晶体析出。在此变化过程中( )A、溶液的质量会减少 B、食盐的溶解度会减小 C、食盐水的溶质质量分数会减小 D、溶液的体积会增大14. 在较高温度下,某溶液所含硝酸钾和氯化钠都已经接近饱和,当其冷却至室温时,析出的晶体经检验几乎不含氯化钠,这是因为 ( )A、氯化钠的溶解度比硝酸钾小 B、氯化钠的溶解度比硝酸钾大 C、氯化钠的溶解度受温度变化小 D、氯化钠的溶解度在室温时更大15. 室温时,对100mL氯化钠饱和溶液作如图操作,最终甲、乙两烧杯中溶液( ) A、溶质质量相同 B、溶质质量分数相同 C、均为不饱和溶液 D、溶剂质量相同
A、溶质质量相同 B、溶质质量分数相同 C、均为不饱和溶液 D、溶剂质量相同二、填空题
-
16. 如图装置试管中加入氢氧化钠固体片刻后,U型管左侧液面将(填“上升”、“下降”或“不变”),产生这一现象的原因是。若加入固体,现象则相反。
 17. 化学中有许多概念是相对的,又是统一的.如图反映了饱和溶液、不饱和溶液、浓溶液以及稀溶液的关系.
17. 化学中有许多概念是相对的,又是统一的.如图反映了饱和溶液、不饱和溶液、浓溶液以及稀溶液的关系.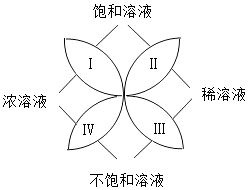 (1)、0.9%的医用生理盐水可归于图中区域(填“I”“II”“III”或“IV”);现有一瓶接近饱和的NaCl溶液,若要使它变为饱和溶液,一般采用的方法是或 .(2)、生产上要配制5000g%的盐酸来清洗钢材,需38%的盐酸(密度为1.19g/cm3)mL(计算结果保留小数点后一位)18. 在 20℃时,向 100g 水中加入 40g 氯化钾,充分搅拌,形成 134g 氯化钾溶液。则该溶液中氯化钾的质量分数为;20℃时氯化钾的溶解 度是g。19. 在一定温度下,向 100g 水中依次加入一定质量的 KCl 固体,充分溶解。加入 KCl 的质量与得到相应溶液质量的关系如图所示。
(1)、0.9%的医用生理盐水可归于图中区域(填“I”“II”“III”或“IV”);现有一瓶接近饱和的NaCl溶液,若要使它变为饱和溶液,一般采用的方法是或 .(2)、生产上要配制5000g%的盐酸来清洗钢材,需38%的盐酸(密度为1.19g/cm3)mL(计算结果保留小数点后一位)18. 在 20℃时,向 100g 水中加入 40g 氯化钾,充分搅拌,形成 134g 氯化钾溶液。则该溶液中氯化钾的质量分数为;20℃时氯化钾的溶解 度是g。19. 在一定温度下,向 100g 水中依次加入一定质量的 KCl 固体,充分溶解。加入 KCl 的质量与得到相应溶液质量的关系如图所示。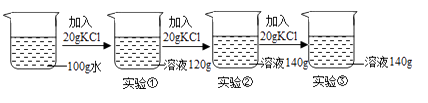 (1)、实验③所得溶液的质量分数是。3 次实验所得溶液质量分数由小到大的关系 是。(2)、实验②的溶液是否为饱和溶液?(填“是”“不是”或者“无法判断”)。20. 下列为氯化钠和氯化铵在不同温度时的溶解度。回答下列问题:
(1)、实验③所得溶液的质量分数是。3 次实验所得溶液质量分数由小到大的关系 是。(2)、实验②的溶液是否为饱和溶液?(填“是”“不是”或者“无法判断”)。20. 下列为氯化钠和氯化铵在不同温度时的溶解度。回答下列问题:温度/℃
0
10
20
30
40
50
氯化铵溶解度/g
29.4
33.3
37.2
41.4
45.8
50.4
氯化钠溶解度/g
35.7
35.8
36.0
36.3
36.6
37.0
(1)、由表中数据可知,溶解度随温度变化较大的物质是。(2)、20 ℃时100 g水最多只能溶解氯化钠g,氯化钠与氯化铵溶解度相等的温度在℃之间。(3)、向烧杯中加入100 g水和50.0 g氯化铵配成50 ℃的溶液,再冷却到20 ℃,烧杯中析出固体为g。三、解答题
-
21. 溶液与人类的生活息息相关,溶液的配制是日常生活和化学实验中的常见操作。(1)、在农业上,常需要用质量分数为16%的氯化钠溶液来选种,现要配制200kg这种溶液,需要氯化钠的质量为多少kg。(2)、化学实验室现有质量分数为98%的浓硫酸,但在实验中常用到较稀的硫酸,要把50g上述浓硫酸稀释为质量分数为20%(密度为1.14g/cm3)的硫酸,稀释后20%硫酸溶液体积为多少mL(计算结果保留至0.1)。22. 根据氯化钠和硝酸钾的溶解度表,回答下列问题:
温度(℃) 10 20 30 40 50 60 70 氯化钠溶解度(克) 35.8 36.0 36.3 36.4 37.0 37.3 37.8 硝酸钾溶解度(克) 20.9 31.6 45.8 63.9 85.5 110 138 (1)、写出硝酸钾和氯化钠具相同溶解度时的温度范围(限表中相邻两个温度之间);(2)、50℃,向100克水中加入90克硝酸钾,充分搅拌后所得溶液质量为;(3)、计算20℃时氯化钠饱和溶液的溶质质量分数。(写出计算过程)四、实验探究题
-
23. 请你参与实验室配制一定溶质质量分数的硝酸钾溶液的实验,并进行实验过程的探究:
 (1)、计算:配制50g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为 g,所需蒸馏水的体积为 mL(水的密度约为1g/mL).(2)、称量:分别在天平左右两盘放上纸片,调节平衡后,应 (填标号).
(1)、计算:配制50g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为 g,所需蒸馏水的体积为 mL(水的密度约为1g/mL).(2)、称量:分别在天平左右两盘放上纸片,调节平衡后,应 (填标号).A.先在托盘上放置所需的砝码,再添加硝酸钾直至天平平衡.
B.先添加所需的硝酸钾,再添加砝码到所在的托盘直至天平平衡.
(3)、【探究一】:在称量过程中,某同学的称量操作如图所示,你认为该操作对本次实验的数据处理的正确性 (填“有”或“没有”)影响,理由是 .(3)量取:准确量取所需蒸馏水要用到的仪器是 (选填图中的标号).
 (4)、溶解:将称量好的硝酸钾和蒸馏水混合溶解.
(4)、溶解:将称量好的硝酸钾和蒸馏水混合溶解.【探究二】:20℃时,将20mL质量分数为10%的硝酸钾溶液,稀释成质量分数为4%的硝酸钾溶液.从表中找出计算所需的数据为: g/mL.
温度℃
质量分数%
20
40
60
4
1.023
1.016
1.007
10
1.063
1.054
1.044
24. 为了探究影响固体溶解性的因素,某同学设计了如下三组实验:因素
第一组
第二组
第三组
实验温度
20℃
20℃
20℃
20℃
80℃
加入溶剂种类
水
酒精
水
水
水
加入溶剂质量
20g
20g
10g
10g
10g
加入固体种类
硝酸钾
硝酸钾
硝酸钾
食盐
硝酸钾
加入固体质量
10g
10g
10g
10g
10g
溶解固体质量
6.2g
0g
3.1g
3.6g
10g
(1)、分析上表,第一组实验研究的因素是;(2)、由上述实验可知,影响固体溶解性的因素是(填序号)①温度 ②加入溶剂种类 ③加入溶剂质量 ④加入固体种类 ⑤加入固体质量
(3)、在第二组实验中,该同学按照如下步骤进行实验(假设溶液损失不计)①用电子天平称取 10.0g 硝酸钾,放入烧杯中;
②量取 10.0mL 水,倒入上述烧杯中,称量烧杯、硝酸钾和水的总质量为 m1g;
③搅拌至硝酸钾不再溶解为止;
④过滤,称量所得硝酸钾溶液和烧杯的总质量为 m2g;
⑤计算:m1-m2=g(结合第二组实验数据进行分析)。 将溶质改为食盐,重复上述步骤进行实验。
由实验可知,20℃时食盐的溶解性(填“>”“﹦”“<”)硝酸钾的溶解性。
(4)、根据上述实验,以下推论正确的是 。A、20℃时,氯化钠的溶解度为 36g/100g 水 B、20℃时,硝酸钾饱和溶液的溶质质量分数为 31% C、第三组实验中的硝酸钾溶液为 80℃时的饱和溶液 D、20℃的任意一杯饱和硝酸钾溶液中,溶质与溶剂的质量比一定相等25. 实验室需要配制15%的氯化钠溶液50g.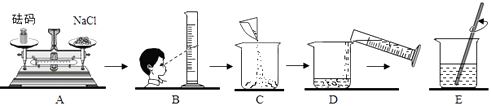 (1)、计算:需要氯化钠的质量为 .(2)、某同学按下图所示步骤依次操作:其中操作错误的步骤是(填字母序号);B中仪器的名称为;E中玻璃棒的作用是 .(3)、若图A中砝码的质量为5g,游码为2.5g,则小明称得的氯化钠质量实际为 .(4)、用已调节平衡的天平称固体时,发现指针偏右,接下来的操作是 .(5)、反思:若称取的氯化钠中含有水分,则所配制的溶液溶质质量分数会;若量水时仰视读数,则配制的溶液溶质质量分数会(填“偏大”、“偏小”或“无影响”)
(1)、计算:需要氯化钠的质量为 .(2)、某同学按下图所示步骤依次操作:其中操作错误的步骤是(填字母序号);B中仪器的名称为;E中玻璃棒的作用是 .(3)、若图A中砝码的质量为5g,游码为2.5g,则小明称得的氯化钠质量实际为 .(4)、用已调节平衡的天平称固体时,发现指针偏右,接下来的操作是 .(5)、反思:若称取的氯化钠中含有水分,则所配制的溶液溶质质量分数会;若量水时仰视读数,则配制的溶液溶质质量分数会(填“偏大”、“偏小”或“无影响”)