2018年河南省普通高中招生化学试卷
试卷更新日期:2018-07-04 类型:中考真卷
一、选择题
-
1. 生活中的下列变化,属于物理变化的是( )A、蜡熔化 B、铁生锈 C、米酿酒 D、纸燃烧2. 开封小笼包是地方特色美食,其主要食材瘦内中富含的营养素为( )A、糖类 B、油脂 C、维生素 D、蛋白质3. “建设美丽中国”是新时代的目标。下列做法不利于减少环境污染的是( )A、回收各种废弃塑料 B、开发和利用新能源 C、工业废水任意排放 D、积极植树、造林、种草4. 下列物质在氧气里燃烧,生成物为白色固体的是( )A、硫 B、镁条 C、铁丝 D、木炭5. 下列各组元素中,元素符号的第一个字母不相同的一组是( )A、锰、钛 B、氩、金 C、铅、铂 D、氦、汞6. 下列有关水的说法正确的是( )A、冰水共存物属于混合物 B、水是由氢元素和氧元素组成的化合物 C、将硬水过滤可得到软水 D、凡是有水生成的反应一定是中和反应7. 下列实验设计不能达到其对应实验目的的是( )A、
 测定空气里氧气的含量
B、
测定空气里氧气的含量
B、 检查装置的气密性
C、
检查装置的气密性
C、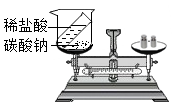 验证质量守恒定律
D、
验证质量守恒定律
D、 证明CO2密度比空气的大
8. 硅是信息技术的关键材料。右图为硅的原子结构示意图,下列说法正确的是( )
证明CO2密度比空气的大
8. 硅是信息技术的关键材料。右图为硅的原子结构示意图,下列说法正确的是( ) A、硅属于稀有气体元素 B、图中n的值为8 C、硅的相对原子质量为14 D、硅元素位于第三周期9. 室温时将少量干冰放入塑料袋中并密封,塑料袋会快速鼓起,其原因是( )
A、硅属于稀有气体元素 B、图中n的值为8 C、硅的相对原子质量为14 D、硅元素位于第三周期9. 室温时将少量干冰放入塑料袋中并密封,塑料袋会快速鼓起,其原因是( )
A、分子的体积变大 B、分子分解变成了原子 C、分子的间隔变大 D、分子由静止变为运动10. 下列区分物质的方法或试剂不正确的是( )A、用带火星的木条区分氧气和氮气 B、用熟石灰区分氯化铵和氯化钾 C、灼烧后闻气味区分羊毛线和腈纶线 D、用酚酞溶液区分硫酸和硫酸钠溶液11. 实验室配制一定溶质质量分数的氯化钠溶液时,下列操作会导致结果偏小的是( )①称量的氯化钠固体中含有不溶性杂质; ②用量筒量取水时仰视读数;
③往烧杯中加水时有水洒出; ④将配制好的溶液装入试剂瓶中时有少量溅出。
A、①② B、①③ C、②④ D、③④12. 过氧化钠(Na2O2)可作呼吸面具中氧气的来源,它与二氧化碳反应后的生成物为( )
A、Na2CO3和H2 B、Na2O和O2 C、NaOH和O2 D、Na2CO3和O213. 甲、乙、丙有如右图所示的转化关系(“→”表示反应一步实现,部分物质和反应条件已略去),下列各组物质按照甲、乙、丙的顺序不符合要求的是( ) A、C、CO、CO2 B、H2O2、H2O、O2 C、KOH、K2CO3、KNO3 D、Fe2O3、FeCl3、Fe(OH)314. 有Mg、Al、Zn的混合物共7.2g,与足量盐酸反应,生成H2的质量可能是( )A、0.2g B、0.6g C、0.8g D、0.9g
A、C、CO、CO2 B、H2O2、H2O、O2 C、KOH、K2CO3、KNO3 D、Fe2O3、FeCl3、Fe(OH)314. 有Mg、Al、Zn的混合物共7.2g,与足量盐酸反应,生成H2的质量可能是( )A、0.2g B、0.6g C、0.8g D、0.9g二、填空题
-
15. 人体中含量最高的金属元素是;在尿素、硫酸钾、磷酸二氢铵三种化肥中,属于复合肥料的是。
16. 乙醇完全燃烧的化学方程式为;高压水枪灭火所依据的灭火原理是;氢气作燃料的优点是(答出一条即可)。
17. 铜丝作导线是利用了其良好的性;铁锈(主要成分是Fe2O3)可用稀硫酸除去,该反应的生成物为H2O和;铝制品耐腐蚀是因其表面生成了致密的氧化铝薄膜,该反应的化学方程式为。
18. 右图是甲、乙两种固体的溶解度曲线。甲和乙的溶解度相等时的温度为℃;t2℃时,分别用甲、乙的固体配制相同质量甲、乙的饱和溶液,所需要水的质量关系为甲乙(填“大于”、“小于”或“等于”); t2℃时,将75g甲的饱和溶液与50g水混合后所得溶液中溶质的质量分数为。 19. A~E均为初中化学常见的物质,它们之间的关系如右图所示(部分物质已经略去)
19. A~E均为初中化学常见的物质,它们之间的关系如右图所示(部分物质已经略去)
已知A是目前世界上年产量最高的金属;B是胃酸的主要成分;C中金属元素的质量分数为40%,其水溶液呈蓝色,常用来配制农药波尔多液;D属于碱;E属于盐。则C的化学式为;A与B反应的化学方程式为;
E转化为D的化学方程式为。
20. 碱式碳酸铜[Cu2(OH)2CO3]受热分解生成氧化铜、水和二氧化碳,反应的化学方程式为;充分加热24g含氧化铜的碱式碳酸铜固体,若反应前后固体中铜元素的质量分数之比为3:4,则该反应生成水和二氧化碳的质量之和为g。
三、简答题
-
21. 右图是某反应的微观示意图。
 (1)、写出图中单质的化学式。(2)、写出该反应的化学方程式。22. 将锌粉加入到一定质量Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,
(1)、写出图中单质的化学式。(2)、写出该反应的化学方程式。22. 将锌粉加入到一定质量Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,可以得到溶液和固体。
(1)、写出会导致溶液质量变小的有关反应的化学方程式。(2)、若所得溶液中只含有一种溶质,请分析所得固体的成分。23. 下图是实验室制取气体的常用装置。 (1)、写出一个用A装置制取O2的化学方程式。
(1)、写出一个用A装置制取O2的化学方程式。
(2)、B和C装置均可制取CO2 , 与B相比较,C的主要优点是什么?(3)、用试管采用排空气法收集H2 , 请在D处方框中画出装置图(只画试管和导气管)。
24. 下图装置可以做CO还原Fe2O3的实验并检验该反应的气体生成物。已知由一氧化碳发生装置得到的CO中混有杂质CO2和H2O。 (1)、写出B装置玻璃管内反应的化学方程式。
(1)、写出B装置玻璃管内反应的化学方程式。
(2)、从环保角度考虑,请写出一种尾气处理方法。
(3)、若没有A装置,则该实验不能达到检验气体生成物的目的,请说明原因。四、综合应用题
-
25. 酸、碱、盐在生产和生活中有广泛的应用。(1)、焙制糕点所用发酵粉中含有碳酸氢钠,其俗名为(填字母代号)。
a.纯碱 b.烧碱 c.苏打 d.小苏打
(2)、右图是氢氧化钠溶液与硫酸反应时溶液pH变化的示意图。
①根据图示判断,该实验是将(填“氢氧化钠溶液”或“硫酸”)滴加到另一种溶液中。
②滴入溶液体积为V2ml时,溶液中的溶质为。
(3)、为除去粗盐水中的可溶性杂质MgSO4、CaCl2 , 某化学小组设计了以下方案:
①过滤用到的玻璃仪器有烧杯、玻璃棒和。
②写出加入Ba(OH)2溶液时反应的化学方程式。(提示:微溶物不形成沉淀)
③溶液X中含们哪些杂质?请设计实验加以证明。(简要写出实验步骤和现象)
(4)、为测定某石灰石样品中碳酸钙的质量分数,称取10g石灰石(杂质不参加反应)放入烧杯中,加入100g稀盐酸,二者恰好完全反应,反应后烧杯中剩余物质的总质量为106.7g(气体的溶解忽略不计)。请计算该样品中碳酸钙的质量分数。