2016-2017学年江西省宜春三中高三上学期期中化学试卷
试卷更新日期:2017-01-18 类型:期中考试
一、选择题
-
1. 下列物质中,不属于合金的是( )A、硬铝 B、黄铜 C、钢铁 D、金箔2. 除去Na2CO3固体中少量NaHCO3的最佳方法是( )A、加入适量盐酸 B、加入NaOH溶液 C、加热 D、配成溶液后通入CO23. 漂白粉的有效成分是( )A、次氯酸钙 B、氯化钙 C、次氯酸 D、次氯酸钙与氯化钙4. 利用焰色反应,人们在烟花中有意识地加入特定金属元素,使焰火更加绚丽多彩.下列说法中正确的是( )A、非金属单质燃烧时火焰均为无色 B、NaCl与Na2CO3灼烧时火焰颜色相同 C、焰色反应均应透过蓝色钴玻璃观察 D、只有金属单质灼烧时火焰才有颜色5. 下列各组物质的分类正确的是( )
①混合物:水玻璃、水银、水煤气
②电解质:明矾、冰醋酸、石膏
③酸性氧化物:CO2、CO,SO3
④同位素:1H,2H2、3H
⑤同素异形体:C80、金刚石、石墨
⑥干冰、液氯都是非电解质.
A、②⑤ B、②⑤⑥ C、②④⑤⑥ D、①②③④⑤⑥6. 设NA为阿伏加德罗常数的数值,下列说法正确的是( )A、常温常压下,8 g O2含有4NA个电子 B、1 L 0.1 mol•L﹣1的氨水中有NA个NH4+ C、标准状况下,22.4 L盐酸含有NA个HCl分子 D、1 mol Na被完全氧化生成Na2O2 , 失去2NA个电子7. 用下列实验装置进行相应实验,能达到实验目的是( )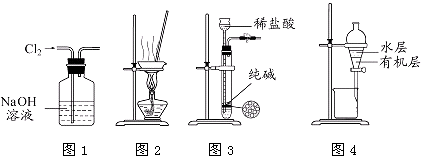 A、用图1所示装置除去Cl2中含有的少量HCl B、用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 C、用图3所示装置制取少量纯净的CO2气体 D、用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层8. 下列反应的离子方程式书写正确的是( )A、钠和冷水反应:Na+2H2O═Na++2OH﹣+H2↑ B、金属铝溶于氢氧化钠溶液中:Al+2OH﹣═Al +H2↑ C、金属铝溶于盐酸中:2Al+6H+═2Al3++3H2↑ D、Fe(OH)3跟盐酸反应:OH﹣+H+═H2O9. 标准状况下V L氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是( )A、ρ= B、ω= C、ω= D、c=10. 卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂.下列对于过氧化钙(CaO2)的叙述错误的是( )A、CaO2具有氧化性,对面粉可能具有增白作用 B、CaO2中阴阳离子的个数比为1:1 C、CaO2和水反应时,每产生1mol O2转移电子4mol D、CaO2和CO2反应的化学方程式为:2CaO2+2CO2=2CaCO3+O211. 已知下列反应:①2BrO3﹣+Cl2=Br2+2ClO3﹣ ②5Cl2+I2+6H2O=2HIO3+10HCl ③ClO3﹣+5Cl﹣+6H+=3Cl2+3H2O判断下列物质氧化能力强弱顺序正确的是( )A、ClO3﹣>BrO3﹣>IO3﹣>Cl2 B、ClO3﹣>BrO3﹣>Cl2>IO3﹣ C、BrO3﹣>ClO3﹣>Cl2>IO3﹣ D、Cl2>BrO3﹣>ClO3﹣>IO3﹣12. 在化学学习中使用数轴的表示方法可起到直观、形象的效果,下列表达中不正确的是( )A、常温下溶液的pH与酸碱性的关系:
A、用图1所示装置除去Cl2中含有的少量HCl B、用图2所示装置蒸干NH4Cl饱和溶液制备NH4Cl晶体 C、用图3所示装置制取少量纯净的CO2气体 D、用图4所示装置分离CCl4萃取碘水后已分层的有机层和水层8. 下列反应的离子方程式书写正确的是( )A、钠和冷水反应:Na+2H2O═Na++2OH﹣+H2↑ B、金属铝溶于氢氧化钠溶液中:Al+2OH﹣═Al +H2↑ C、金属铝溶于盐酸中:2Al+6H+═2Al3++3H2↑ D、Fe(OH)3跟盐酸反应:OH﹣+H+═H2O9. 标准状况下V L氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρ g/mL,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是( )A、ρ= B、ω= C、ω= D、c=10. 卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂.下列对于过氧化钙(CaO2)的叙述错误的是( )A、CaO2具有氧化性,对面粉可能具有增白作用 B、CaO2中阴阳离子的个数比为1:1 C、CaO2和水反应时,每产生1mol O2转移电子4mol D、CaO2和CO2反应的化学方程式为:2CaO2+2CO2=2CaCO3+O211. 已知下列反应:①2BrO3﹣+Cl2=Br2+2ClO3﹣ ②5Cl2+I2+6H2O=2HIO3+10HCl ③ClO3﹣+5Cl﹣+6H+=3Cl2+3H2O判断下列物质氧化能力强弱顺序正确的是( )A、ClO3﹣>BrO3﹣>IO3﹣>Cl2 B、ClO3﹣>BrO3﹣>Cl2>IO3﹣ C、BrO3﹣>ClO3﹣>Cl2>IO3﹣ D、Cl2>BrO3﹣>ClO3﹣>IO3﹣12. 在化学学习中使用数轴的表示方法可起到直观、形象的效果,下列表达中不正确的是( )A、常温下溶液的pH与酸碱性的关系: B、硫的化合物中化合价与其氧化性、还原性的关系:
B、硫的化合物中化合价与其氧化性、还原性的关系:  C、Fe在Cl2中的燃烧产物:
C、Fe在Cl2中的燃烧产物:  D、氨水与SO2反应后溶液中的铵盐:
D、氨水与SO2反应后溶液中的铵盐:  13. 将3.20g Cu跟50.0mL 10.0mol•L﹣1的HNO3充分反应,还原产物有NO和NO2 , 若反应后溶液中有xmol H+ , 则此时溶液中含NO3﹣的物质的量为( )A、mol B、(x+0.1)mol C、2x mol D、0.1x mol14. R2O8n﹣在一定条件下可以把Mn2+氧化成MnO4﹣ , 若反应中R2O8n﹣变为RO42﹣ , 又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值为( )A、1 B、2 C、3 D、415. 将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,反应后Fe有剩余,则容器中其它存在的单质或离子只能是( )A、Cu、Fe3+ B、Fe2+、Fe3+ C、Cu、Cu2+ D、Cu、Fe2+16. 1L某混合溶液中,溶质X、Y的浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.1mol/L的氢氧化钠或硫酸溶液),所得沉淀的物质的量随着Z溶液的体积变化关系如图所示,则X、Y、Z分别是( )
13. 将3.20g Cu跟50.0mL 10.0mol•L﹣1的HNO3充分反应,还原产物有NO和NO2 , 若反应后溶液中有xmol H+ , 则此时溶液中含NO3﹣的物质的量为( )A、mol B、(x+0.1)mol C、2x mol D、0.1x mol14. R2O8n﹣在一定条件下可以把Mn2+氧化成MnO4﹣ , 若反应中R2O8n﹣变为RO42﹣ , 又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值为( )A、1 B、2 C、3 D、415. 将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,反应后Fe有剩余,则容器中其它存在的单质或离子只能是( )A、Cu、Fe3+ B、Fe2+、Fe3+ C、Cu、Cu2+ D、Cu、Fe2+16. 1L某混合溶液中,溶质X、Y的浓度都为0.1mol/L,向混合溶液中滴加某溶液Z(0.1mol/L的氢氧化钠或硫酸溶液),所得沉淀的物质的量随着Z溶液的体积变化关系如图所示,则X、Y、Z分别是( ) A、AlCl3、FeCl3、NaOH B、AlCl3、MgCl2、NaOH C、NaAlO2、Ba(OH)2、H2SO4 D、NaAlO2、BaCl2、H2SO4
A、AlCl3、FeCl3、NaOH B、AlCl3、MgCl2、NaOH C、NaAlO2、Ba(OH)2、H2SO4 D、NaAlO2、BaCl2、H2SO4二、非选择题
-
17. O2和O3是氧元素的两种单质,根据其分子式完成下列各题:(1)、等质量的O2和O3所含分子个数比为 , 原子个数比为 .(2)、等温等压下,等体积的O2和O3所含分子个数比为 , 原子个数比为 , 质量比为 .(3)、设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是(用含NA的式子表示).18. 三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3 , 请根据要求回答下列问题:(1)、反应过程中,被氧化与被还原的元素原子的物质的量之比为 .(2)、写出该反应的化学方程式 . 若反应中生成0.2mol HNO3 , 转移的电子数目为个.(3)、NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现.你判断该气体泄漏时的现象是 .(4)、一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有(填化学式).19. 硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外研究小组测定该补血剂中铁元素的含量,实验步骤如下:

请回答下列问题:
(1)、证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 , 该过程的现象为: .(2)、步骤②加入过量H2O2的目的: .(3)、步骤③中反应的离子方程式: .(4)、若实验无损耗,则每片补血剂含铁元素的质量 g.(5)、该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定.(5Fe2++MnO4﹣+8H+=5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需 .
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是 .
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为色.若滴定到终点时俯视滴定管刻度线,对测量值有何影响?( 填“偏高、偏低或无影响”).
20. 有一瓶澄清的溶液,其中可能含有NH4+、Na+、Ba2+、Al3+、Fe3+、I﹣、NO3﹣、CO32﹣、SO42﹣、AlO2﹣ , 取该溶液进行以下实验:(1)、取pH试纸检验,溶液呈强酸性,可以排除离子的存在.(2)、取出部分溶液,加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色,可以排除离子的存在.(3)、写出(2)所发生的反应的离子方程式 .(4)、另取出部分溶液逐渐加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,则又可以排除离子的存在.(5)、取出(4)部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,证明离子存在,又可排除离子的存在.(6)、将(4)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝.根据上述实验事实确定:该溶液中肯定存在的离子是肯定不存在的离子是 , 还不能确定是否存在的离子是 , 鉴别的方法是(具体的操作方法).