江苏省扬州市2018年中考化学试题
试卷更新日期:2018-06-29 类型:中考真卷
一、选择题
-
1. 下列做法与低碳环保理念一致的是( )A、生活垃圾分类回收 B、市区尽量开车出行 C、工业废气直接排放 D、化石燃料过度使用2. 第19届省运会在我市拉开帷幕,游泳比赛的池水中含4%左右的CuSO4。CuSO4属于( )A、酸 B、碱 C、盐 D、有机物3. 以下我国古代的制作或技术涉及到化学变化的是( )A、
 烧制陶罐
B、
烧制陶罐
B、 雕刻石像
C、
雕刻石像
C、 水车灌溉
D、
水车灌溉
D、 预报地震
4. 下列物质由分子组成的是( )A、铁 B、氯化钠 C、水 D、硝酸钾5. “电视之星18”是第21届俄罗斯足球世界杯的比赛用球。它首次由从甘蔗中提取的橡胶制成,节约了资源。下列不属于橡胶性质的是( )
预报地震
4. 下列物质由分子组成的是( )A、铁 B、氯化钠 C、水 D、硝酸钾5. “电视之星18”是第21届俄罗斯足球世界杯的比赛用球。它首次由从甘蔗中提取的橡胶制成,节约了资源。下列不属于橡胶性质的是( )
A、高弹性 B、耐磨损 C、绝缘性好 D、易溶于水6. 下列气体中可用向下排气法收集的是( )A、H2 B、N2 C、O2 D、SO27. 下列物质显酸性的是( )A、食盐水 B、食醋 C、蔗糖溶液 D、肥皂水8. 2018年2月1日起扬州市主城区内严禁燃放烟花爆竹。下列为“禁止放鞭炮”标志的是( )A、 B、
B、 C、
C、 D、
D、 9. 煤炭燃烧排出的尾气中,能形成酸雨的是( )A、N2 B、CO2 C、SO2 D、H2O10. 下列各组物质,仅用水无法鉴别的是( )A、CuSO4、Na2SO4 B、KCl、NaCl C、CaCO3、Na2CO3 D、NH4NO3、NaNO311. 下列反应中属于复分解反应的是( )A、2Mg+ O2 2MgO B、Cu+2AgNO3=Cu(NO3)2+2Ag C、CuCl2 Cu+Cl2↑ D、2NaOH+H2SO4=Na2SO4+2H2O12. 3Cl2+6NaOH 5NaCl+X+3H2O的反应中,X的化学式是( )A、O2 B、NaClO C、HCl D、NaClO313. 过氧乙酸(C2H4O3)是常见的消毒剂。下列有关过氧乙酸的说法正确的是( )A、分子中含O3分子 B、氢、氧原子的个数比为4:3 C、分子中有9种元素 D、碳的质量分数为24%14. 某反应前后分子变化的微观示意图如下。下列说法正确的是( )
9. 煤炭燃烧排出的尾气中,能形成酸雨的是( )A、N2 B、CO2 C、SO2 D、H2O10. 下列各组物质,仅用水无法鉴别的是( )A、CuSO4、Na2SO4 B、KCl、NaCl C、CaCO3、Na2CO3 D、NH4NO3、NaNO311. 下列反应中属于复分解反应的是( )A、2Mg+ O2 2MgO B、Cu+2AgNO3=Cu(NO3)2+2Ag C、CuCl2 Cu+Cl2↑ D、2NaOH+H2SO4=Na2SO4+2H2O12. 3Cl2+6NaOH 5NaCl+X+3H2O的反应中,X的化学式是( )A、O2 B、NaClO C、HCl D、NaClO313. 过氧乙酸(C2H4O3)是常见的消毒剂。下列有关过氧乙酸的说法正确的是( )A、分子中含O3分子 B、氢、氧原子的个数比为4:3 C、分子中有9种元素 D、碳的质量分数为24%14. 某反应前后分子变化的微观示意图如下。下列说法正确的是( )
“
 ”“
”“  ”和“
”和“  ”表示不同元素的原子A、反应物中没有单质 B、图中共表示了9种物质 C、反应后元素种类增多 D、反应后原子个数不变15. 下列说法正确的是( )A、除去二氧化碳中混有的氯化氢气体,可通过氢氧化钠溶液洗气 B、测定溶液的pH时,需预先用蒸馏水将pH试纸润湿 C、比较铁、铜的活动性强弱,可分别将这两种金属投入稀盐酸中观察现象 D、若厨房天然气泄漏,应立即打开脱排油烟机进行排气16. 粗盐提纯和溶液配制的实验中涉及以下实验操作,其中不正确的是( )
”表示不同元素的原子A、反应物中没有单质 B、图中共表示了9种物质 C、反应后元素种类增多 D、反应后原子个数不变15. 下列说法正确的是( )A、除去二氧化碳中混有的氯化氢气体,可通过氢氧化钠溶液洗气 B、测定溶液的pH时,需预先用蒸馏水将pH试纸润湿 C、比较铁、铜的活动性强弱,可分别将这两种金属投入稀盐酸中观察现象 D、若厨房天然气泄漏,应立即打开脱排油烟机进行排气16. 粗盐提纯和溶液配制的实验中涉及以下实验操作,其中不正确的是( )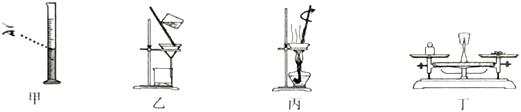 A、用图甲所示仪器量取液体 B、用图乙所示装置过滤悬浊液 C、用图丙所示装置蒸发溶液 D、用图丁所示仪器称量固体17. KNO3与KCl的溶解度曲线如右图所示。下列说法正确的是( )
A、用图甲所示仪器量取液体 B、用图乙所示装置过滤悬浊液 C、用图丙所示装置蒸发溶液 D、用图丁所示仪器称量固体17. KNO3与KCl的溶解度曲线如右图所示。下列说法正确的是( )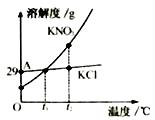 A、KNO3的溶解度比KCl的溶解度大 B、t1温度下的KCl的饱和溶液升温至t2 , 有晶体析出 C、A点所表示的KCl饱和溶液溶质的质量分数为29% D、冷却热的KNO3饱和溶液可获得KNO3晶体18. 下列物质的性质与应用对应关系正确的是( )A、小苏打能与酸反应,可用作治疗胃酸过多的药剂 B、氮气熔沸点低,可用作保护气 C、碳酸氢铵受热易分解,可用作氮肥 D、铝片有金属光泽,可用作导电材料19. 向滴有酚酞的盐酸溶液中逐滴加入氢氧化钠溶液,所得溶液的pH与加入溶液体积关系如右图所示。下列说法正确的是( )
A、KNO3的溶解度比KCl的溶解度大 B、t1温度下的KCl的饱和溶液升温至t2 , 有晶体析出 C、A点所表示的KCl饱和溶液溶质的质量分数为29% D、冷却热的KNO3饱和溶液可获得KNO3晶体18. 下列物质的性质与应用对应关系正确的是( )A、小苏打能与酸反应,可用作治疗胃酸过多的药剂 B、氮气熔沸点低,可用作保护气 C、碳酸氢铵受热易分解,可用作氮肥 D、铝片有金属光泽,可用作导电材料19. 向滴有酚酞的盐酸溶液中逐滴加入氢氧化钠溶液,所得溶液的pH与加入溶液体积关系如右图所示。下列说法正确的是( )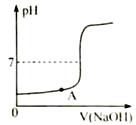 A、反应过程中溶液温度降低 B、A点对应溶液的溶质为HCl、NaCl C、恰好完全反应时溶液显中性 D、反应过程中溶液的颜色由红色变为无色20. 铜元素有多种氧化物,如CuO、Cu2O。称取14.4 g仅含Cu、O两种元素的固体样品、采用如下装置实验(夹持装置省略)。测得实验前后装置B增重4.4g。下列说法正确的是( )
A、反应过程中溶液温度降低 B、A点对应溶液的溶质为HCl、NaCl C、恰好完全反应时溶液显中性 D、反应过程中溶液的颜色由红色变为无色20. 铜元素有多种氧化物,如CuO、Cu2O。称取14.4 g仅含Cu、O两种元素的固体样品、采用如下装置实验(夹持装置省略)。测得实验前后装置B增重4.4g。下列说法正确的是( )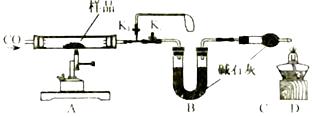 A、装置B的作用是吸收反应生成的H2O和CO2 B、实验开始前应先关闭K2 , 打开K1 , 让CO通一段时间 C、根据实验数据进行计算,可以确定该固体为Cu2O D、若缺少装置C,则实验所得Cu、O个数比偏高21. 空气是宝贵的自然资源,下图是以空气等为原料合成尿素[CO(NH2)2]的流程。请按要求回答相关问题:
A、装置B的作用是吸收反应生成的H2O和CO2 B、实验开始前应先关闭K2 , 打开K1 , 让CO通一段时间 C、根据实验数据进行计算,可以确定该固体为Cu2O D、若缺少装置C,则实验所得Cu、O个数比偏高21. 空气是宝贵的自然资源,下图是以空气等为原料合成尿素[CO(NH2)2]的流程。请按要求回答相关问题: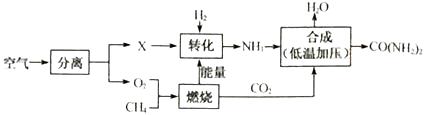 (1)、空气属于(填“纯净物”或“混合物”),X是空气中含量最多的气体,其分子式为。(2)、图中分离空气的过程属于变化(填“物理”或“化学”)。(3)、空气中含有的少量稀有气体的化学性质(填“活泼”或“稳定”)。(4)、实验室用大理石和稀盐酸制取二氧化碳的化学反应方程式为;二氧化碳的密度比空气(填“大”或“小”)。(5)、①天然气的主要成分是CH4 , 天然气属于再生资源(填“可”或“不可”)。
(1)、空气属于(填“纯净物”或“混合物”),X是空气中含量最多的气体,其分子式为。(2)、图中分离空气的过程属于变化(填“物理”或“化学”)。(3)、空气中含有的少量稀有气体的化学性质(填“活泼”或“稳定”)。(4)、实验室用大理石和稀盐酸制取二氧化碳的化学反应方程式为;二氧化碳的密度比空气(填“大”或“小”)。(5)、①天然气的主要成分是CH4 , 天然气属于再生资源(填“可”或“不可”)。②点燃CH4之前应。 8g CH4完全燃烧消耗32gO2 , 生成agCO2和18gH2O,则a=。
③由CH4在该流程中的作用表明:化学反应中发生物质变化的同时也会伴随有变化(填“能量”或“原子个数”)。
(6)、尿素属于(填“氮肥”、“磷肥”或“钾肥”);写出NH3合成尿素的化学反应方程式。22. 日常生活、社会发展与化学密切相关。I.大米、番茄和牛奶是生活中常见的食品,每100g食品中营养成分的含量如下表:
蛋白质/g
脂肪/g
糖类/g
矿物质/mg
维生素C/mg
钙
磷
铁
大米
6.7
0.9
78
7
136
—
0.05
番茄
0.6
0.3
2
8
37
0.4
11
牛奶
3.1
3.5
6
120
90
0.1
1
(1)、上表中的钙、磷、铁指的是(填字母)。A.原子 B.单质 C.元素
(2)、人体若缺少元素(填元素符号),则可能易患佝偻病,上表中富含该元素的食品是
(3)、大米中的主要成分淀粉属于(填字母)。A.糖类 B.油脂 C.蛋白质
(4)、番茄中富含维生素C,其化学式为C6H8O6 , 相对分子质量为 , C、H、O三种元素的质量比为。向维生素C溶液中滴入紫色石蕊试液,石蕊试液变红,说明维生素C溶液具有(填“酸性”或“碱性”)。(5)、II.2019年扬州将开通高铁。它不仅方便人们的出行,更助力扬州经济的发展。
高铁的机身采用铝合金材料,下列不属于该合金性质的是(填字母)。A.密度大 B.耐腐蚀 C.硬度大
(6)、高铁路基中使用的钢筋混凝土材料属于(填“有机高分子材料”或“复合材料”)。高铁机身通过受电弓滑板与沿线架设的3万伏高压输电线相连,这是利用了受电弓滑板的性(填“导电”或“导热”)。23. 氧气是我们身边无法离开的物质。某兴趣小组对氧气的研究如下: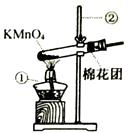 (1)、I.氧气的制备:
(1)、I.氧气的制备:写出右图中有标号仪器的名称:① , ②。
(2)、写出用KMnO4制取O2的化学反应方程式。该装置中棉花团的作用是 , 图中装置一处明显的错误是。(3)、II.氧气的收集:[实验1]用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃时停止收集,测定瓶中氧气的含量,重复实验3次。
[实验2]用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃后,继续收集40秒,测定瓶中氧气的含量,重复实验3次。
[实验3]用排水法收集氧气,测定瓶中氧气的含量,重复实验3次。
实验数据:
实验1
实验2
实验3
氧气的体积分数(%)
79.7
79.6
79.9
88.4
89.0
87.9
90.0
89.8
89.3
氧气的平均体积分数(%)
79.7
88.4
89.7
数据分析:
由实验1、2可知,用向上排空气法收集氧气时,为提高获得的氧气体积分数,可采取的措施是。
(4)、不考虑操作因素,实验3获得的氧气体积分数不能达到100%的主要原因是。(5)、Ⅲ.铁丝在氧气中燃烧铁丝在纯净氧气中燃烧的化学反应方程式为 。
(6)、铁丝燃烧时火星四射,经研究表明产生火星四射现象的原因,可能是同时生成了某种气体,推测该气体是(填化学式)。将燃烧后的黑色固体粉碎后,滴加稀盐酸,若产生气泡,则原因是(用化学反应方程式表示)。24. 氢气作为新能源有很多优点,制取与储存氢气是氢能源利用领域的研究热点。(1)、I.制氢:铁酸锌(ZnFe2O4)可用于循环分解水制气,其反应可表示为:6ZnFe2O4 6ZnO+4Fe3O4+O2↑;3ZnO+2Fe3O4+H2O 3ZnFe2O4+H2↑
ZnFe2O4中Fe的化合价为。
(2)、该循环制氢中不断消耗的物质是(填化学式),得到H2和O2的质量比为。(3)、氢气作为新能源的优点有(任写一点)。该循环法制氢的不足之处是。(4)、Ⅱ.贮氢:合金Mg2Cu是一种潜在的贮氢材料,高温时在氩气保护下,由一定质量比的Mg、Cu单质熔炼获得。该合金在一定条件下完全吸氢生成氢化物和另一种合金,其化学方程式为:2Mg2Cu+ 3H2 3MgH2+MgCu2熔炼制备Mg2Cu合金时,通入氩气的目的是。
(5)、氢化物MgH2与水反应生成一种碱,并释放出H2。 其化学反应方程式为。(6)、11.2g Mg2Cu完全吸氢后所得混合物与过量盐酸反应,放出H2的质量为g。25. 某工厂产生的废渣主要成分是含钙的化合物(杂质为Fe2O3)。用该废渣制取CaCl2晶体(CaCl2·xH2O)并进行组成测定,其制取的流程如下图所示: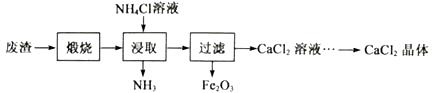
已知:NH4Cl溶液显酸性,且浓度越高酸性越强
(1)、XRD图谱可用于判断某固态物质是否存在。右图为煅烧前后废渣的XRD图谱。写出煅烧时发生的化学反应方程式。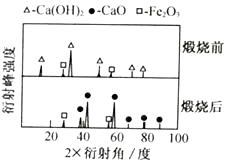 (2)、浸取时需连续搅拌,其目的是;生成的NH3能使湿润的红色石蕊试纸变色。(3)、在其它条件相同的情况下,CaCl2的产率随浸取温度的变化如下图所示。则宜选择的浸取温度为℃左右。
(2)、浸取时需连续搅拌,其目的是;生成的NH3能使湿润的红色石蕊试纸变色。(3)、在其它条件相同的情况下,CaCl2的产率随浸取温度的变化如下图所示。则宜选择的浸取温度为℃左右。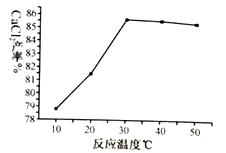 (4)、若使用过量浓度较高的NH4Cl溶液,则所得CaCl2溶液中会含有NH4Cl、(填化学式)等杂质。(5)、过滤得到的Fe2O3在高温下可与CO反应,写出该反应的化学方程式。
(4)、若使用过量浓度较高的NH4Cl溶液,则所得CaCl2溶液中会含有NH4Cl、(填化学式)等杂质。(5)、过滤得到的Fe2O3在高温下可与CO反应,写出该反应的化学方程式。96测定晶体(CaCl2·xH2O)的组成:
a.称取14.7000g CaCl2晶体于锥形瓶内,加入适量蒸馏水.使其全部溶解。
b.再向其中加入足量的Na2CO3溶液,静置。
C.过滤、洗涤、干燥、称量,得到10.0000g固体。
①通过计算,确定x的值(写出计算过程)。。
②判断步骤b中沉淀完全的方法是:静置,向上层清液中滴加 , 则说明已沉淀完全;若沉淀不完全,则测得的x值比实际值(填“偏大”、“偏小”或“ 不变”。