2016-2017学年福建省福州市八县一中联考高三上学期期中化学试卷
试卷更新日期:2017-01-17 类型:期中考试
一、选择题
-
1. 化学与生活、生产、环境等社会实际密切相关.下列叙述正确的是( )A、铝热反应是炼铁最常用的方法 B、硅是现代光学及光纤制品的基本原料 C、采用“静电除尘”“燃煤固硫”“汽车尾气催化净化”等方法可提高空气质量 D、袋装食品常用生石灰包作为食品的抗氧化剂2. 分类是化学学习和研究的常用手段,下列分类依据和结论都正确的是( )A、四氯化碳﹣非电解质 氯化银﹣强电解质 碳酸﹣弱电解质 B、NO2﹣酸性氧化物 CuO﹣碱性氧化物 Al2O3﹣两性氧化物 C、冰醋酸、纯碱、芒硝、生石灰分别属于酸、碱、盐、氧化物 D、碘酒、淀粉溶液、水雾、纳米材料均为胶体3. 下列各组物质中,甲、乙、丙、丁之间通过一步反应就能实现如图所示变化的是( )
选项
甲
乙
丙
丁

A
S
SO2
SO3
H2SO4
B
N2
NH3
NO
NO2
C
CuO
Cu
Cu(OH)2
CuCl2
D
Al
AlCl3
NaAlO2
Al2(SO4)3
A、A B、B C、C D、D4. 设NA为阿伏加德罗常数的值,下列说法正确的是( )A、标准状况下,22.4 L 四氯化碳(CCl4)含有的碳原子数目为NA B、CO2通过Na2O2使其增重5.6g时,反应中转移的电子数为0.4 NA C、0.2mol Fe与0.2 mol Cl2反应时失电子数为0.6NA D、常温常压下,29.8 g KCl与NaClO的固体混合物中阴离子的数目为0.4 NA5. 关于下列各装置图的叙述中,正确的是( ) A、用图A装置制取少量CO2气体 B、多余的NH3可用图B装置吸收 C、装置C可分离沸点不同且互溶的液体混合物 D、图D可检查装置的气密性6. 实验室需要450mL 0.1mol•L﹣1的NaCl溶液,下列情况会使所配溶液浓度偏高的是( )A、用托盘天平称取NaCl固体2.9 g B、胶头滴管加水定容时,有少量水滴到容量瓶外 C、定容时俯视读数 D、称量固体时,天平的两个托盘上放两张质量相等的纸片,其他操作均正确7. 科学的假设与猜想是科学探究的先导和价值所在.在下列假设或猜想引导下的探究肯定没有意义的是( )A、探究SO2和Na2O2反应可能有Na2SO4生成 B、探究NO和N2O可能化合生成NO2 C、探究NO2可能被NaOH溶液完全吸收生成NaNO2、NaNO3和H2O D、探究向滴有酚酞试液的NaOH溶液中通入Cl2 , 酚酞红色褪去的原因是溶液的酸碱性改变还是HClO的漂白作用8. 下列离子或分子在溶液中能大量共存且满足相应要求的是( )
A、用图A装置制取少量CO2气体 B、多余的NH3可用图B装置吸收 C、装置C可分离沸点不同且互溶的液体混合物 D、图D可检查装置的气密性6. 实验室需要450mL 0.1mol•L﹣1的NaCl溶液,下列情况会使所配溶液浓度偏高的是( )A、用托盘天平称取NaCl固体2.9 g B、胶头滴管加水定容时,有少量水滴到容量瓶外 C、定容时俯视读数 D、称量固体时,天平的两个托盘上放两张质量相等的纸片,其他操作均正确7. 科学的假设与猜想是科学探究的先导和价值所在.在下列假设或猜想引导下的探究肯定没有意义的是( )A、探究SO2和Na2O2反应可能有Na2SO4生成 B、探究NO和N2O可能化合生成NO2 C、探究NO2可能被NaOH溶液完全吸收生成NaNO2、NaNO3和H2O D、探究向滴有酚酞试液的NaOH溶液中通入Cl2 , 酚酞红色褪去的原因是溶液的酸碱性改变还是HClO的漂白作用8. 下列离子或分子在溶液中能大量共存且满足相应要求的是( )选项
离子或分子
要 求
A
K+、SO42﹣、Cl﹣、HS﹣
c(K+)<c(SO42﹣)
B
Fe3+、Na+、NO3﹣、ClO﹣
溶液pH=1
C
Na+、Al3+、Cl﹣、SO42﹣
滴加氨水立即有沉淀产生
D
NH4+、Ba2+、NO3﹣、CH3COOH
滴加NaOH溶液立即有气泡产生
A、A B、B C、C D、D9. 下列类比关系正确的是( )A、Na2O2与CO2反应生成Na2CO3和O2 , 则Na2O2与SO2反应可生成Na2SO3和O2 B、Fe与Cl2反应生成FeCl3 , 则Fe与I2反应可生成FeI3 C、钠与氧气在不同条件下反应会生成两种不同的氧化物,则Li与氧气反应也能生成Li2O或Li2O2 D、Al与Fe2O3能发生铝热反应,则Al与MnO2也能发生铝热反应10. SO2通入BaCl2溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则图中右侧Y形管中放置的药品组合不符合要求的是(必要是可以加热)( ) A、Cu和浓硝酸 B、CaO和浓氨水 C、大理石和稀盐酸 D、高锰酸钾溶液和浓盐酸11. 下列实验设计能完成或实验结论合理的( )
A、Cu和浓硝酸 B、CaO和浓氨水 C、大理石和稀盐酸 D、高锰酸钾溶液和浓盐酸11. 下列实验设计能完成或实验结论合理的( )操作及现象
结 论
A
用蒸馏水润湿的pH试纸测溶液的pH
一定会使测定结果偏低
B
向硅酸钠溶液中,滴入硫酸
可以验证S的氧化性强于Si
C
将SO2通入溴水中,溴水褪色
SO2具有漂白性
D
向含有少量FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取分液
除去FeCl2溶液中的FeBr2
A、A B、B C、C D、D12. 能正确表示下列反应的离子方程式是( )A、磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3﹣═3Fe3++NO↑+3H2O B、向Na2SiO3溶液中通入过量SO2:SiO32﹣+SO2+H2O═H2SiO3↓+SO32﹣ C、NaHSO4溶液与Ba(OH)2溶液反应,当SO42﹣完全沉淀时:H++SO42﹣+OH﹣+Ba2+═BaSO4↓+H2O D、Na2S2O3溶液中加入稀硫酸:2S2O32﹣+4H+═SO42﹣+3S↓+2H2O13. 某溶液可能含有Cl﹣、SO42﹣、CO32﹣、NH4+、Fe3+、Al3+和K+ , 取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.由此可知有关原溶液中( )A、至少存在5种离子 B、SO42﹣、NH4+、一定存在,Cl﹣可能不存在 C、Cl﹣一定存在,且c(Cl‑)≥0.4mol/L D、CO32﹣、Al3+一定不存在,K+可能存在14. 将一定量Fe和Fe2O3的混合物放入300mL 2mol/L的硝酸溶液中,反应完全后无固体剩余,生成4.48L NO气体(标准状况),再向反应后的溶液中加入1mol/L的NaOH溶液,要使铁元素全部沉淀下来,所加NaOH溶液的体积最少是( )A、400mL B、500mL C、450mL D、无法确定15.向含Fe2+、I﹣、Br﹣的溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b﹣a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素.下列说法正确的是( )
 A、线段Ⅱ表示Br﹣的变化情况 B、原溶液中n(FeBr2):n(FeI2)=1:3 C、线段Ⅳ表示IO3﹣的变化情况 D、根据图象无法计算a的值
A、线段Ⅱ表示Br﹣的变化情况 B、原溶液中n(FeBr2):n(FeI2)=1:3 C、线段Ⅳ表示IO3﹣的变化情况 D、根据图象无法计算a的值二、填空题
-
16. 三氟化氮(NF3)是一种无色、无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有HF、NO和HNO3 , 请根据要求回答下列问题:(1)、反应过程中,氧化产物是 , 被氧化与被还原的元素原子的物质的量之比为 .(2)、写出该反应的化学方程式: . 若反应中生成0.2mol HNO3 , 转移的电子数目为个.(3)、三氟化氮可由氨气和氟气反应得到:4NH3+3F2═NF3+3NH4F.据题意推测NF3、F2、NO三种气体中,氧化性由弱到强的顺序为 .(4)、NF3是一种无色、无味的气体,一旦NF3在空气中泄漏,却还是易于发现.你判断该气体泄漏时的现象是NaNO3 .(5)、一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少污染,其产物除NaNO2、NaF、H2O外,还肯定有(填化学式).17. 已知A~H是中学化学中的常见物质,A、C、G是金属,E、F是氧化物,B溶于水得蓝色溶液,它们有如图所示的关系(反应中生成的水已略去).试回答下列问题.
 (1)、推断填写物质化学式:A是 , D是 , H是(2)、反应④的化学方程式为 .(3)、用金属C制备另一种金属单质是工业上较常用的方法.如:2C+4BaO 3Ba↑+BaO•C2O3
(1)、推断填写物质化学式:A是 , D是 , H是(2)、反应④的化学方程式为 .(3)、用金属C制备另一种金属单质是工业上较常用的方法.如:2C+4BaO 3Ba↑+BaO•C2O3①常温下C的金属性比Ba的金属性(选填“强”“弱”).
②利用上述方法可制取Ba的主要原因是 .
a、高温时C的活泼性大于Ba
b、高温有利于BaO分解
c、高温时BaO•C2O3比C2O3稳定
d、金属Ba的沸点比金属C的低
(4)、H水溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为(5)、将51.2克的A投入200毫升的硝酸溶液中恰好反应完全,产生标准状况下的NO2、NO共31.36L,求硝酸的浓度 mol•L﹣1 .18. 孔雀石的主要成分为Cu2(OH)2CO3 , 还含少量二价铁和三价铁的氧化物及硅的氧化物.如图1是实验室以孔雀石为原料制备胆矾晶体的流程图:
请回答下列问题:
(1)、溶液A中的金属离子有 . 从下列所给试剂中选择:实验步骤中试剂①为(填代号)a、KMnO4 b、HNO3c、H2O2 d、Cl2
(2)、根据图2有关数据,你认为工业上加入试剂①氧化操作时应采取的措施是:溶液温度控制在℃,pH控制在 , 氧化时间为小时左右.(3)、欲测定溶液A中Fe2+的浓度,可用KMnO4标准溶液滴定,反应中MnO4﹣还原为Mn2+ , 取A溶液20.00mL,用去0.0240mol/L KMnO4溶液16.00mL时,恰好达到滴定终点,则A溶液中Fe2+浓度为 mol/L.(4)、请设计一种实验方案检验溶液C中Fe3+是否完全除去(写出操作步骤、现象和结论) .(5)、由溶液C获得胆矾晶体,需要经过蒸发浓缩、、过滤等操作.除烧杯漏斗外过滤操作还用到另一玻璃仪器,该仪器在此操作中的主要作用是 .(6)、为测定胆矾中结晶水数目,称取24.8g硫酸铜晶体盛装在干燥的(填仪器名称)里,灼烧至质量不再改变时,称量粉末的质量为16.0g.,则计算得胆矾(CuSO4•nH2O)中n=(计算结果精确到0.1).
19. 氢化钙(CaH2)固体是登山运动员常用的能源提供剂.氢化钙要密封保存,一旦接触到水就发生反应生成氢氧化钙和氢气,氢化钙在一定条件下与氧气反应生成的产物不只一种.氢化钙通常用氢气与金属钙加热制取,如图1是模拟制取装置.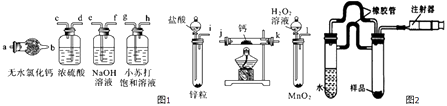
请回答下列问题:
(1)、利用上述装置制取氢化钙时按气流方向连接顺序为(填仪器接口的字母编号).i→→→→→→→a
(2)、装有无水氯化钙装置的作用是 .(3)、根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;打开分液漏斗活塞; (请按正确的顺序填入下列步骤的标号).A、加热反应一段时间 B、收集气体并检验其纯度 C、关闭分液漏斗活塞 D、停止加热,充分冷却(4)、甲同学设计了一个实验,测定上述实验中得到的氢化钙的纯度.请完善下列实验步骤:①样品称量;
②加入溶液(填化学式),搅拌;
③(填操作名称);洗涤;干燥
④称量碳酸钙.
(5)、利用上述题目中给出的装置(试剂可另选)设计实验,用化学方法证明产物中含有氢化钙,写出实验简要步骤及观察到的现象 .(6)、乙同学利用图2所示装置测定上述实验中得到的氢化钙的纯度.他称取46mg所制得的氢化钙样品,记录开始时注射器活栓停留在lO.00mL刻度处,反应结束后充分冷却,活栓最终停留在57.04mL刻度处(上述气体体积均在标准状况下测定).试通过计算求样品中氢化钙的纯度: .