2016-2017学年天津市河东区高二上学期期中化学试卷
试卷更新日期:2017-01-17 类型:期中考试
一、选择题
-
1. 化学与人类生活、社会可持续发展密切相关.下列措施有利于节能减排、保护环境的是( )
①加快化石燃料的开采与使用;
②研发易降解的生物农药;
③应用高效洁净的能源转换技术;
④田间焚烧秸秆;
⑤推广使用节能环保材料.
A、①③⑤ B、②③⑤ C、①②④ D、②④⑤2. 下列反应中,属于氧化还原反应同时又是吸热反应的是( )A、Ba(OH)2•8H2O与NH4Cl反应 B、铝与稀盐酸 C、灼热的炭与水蒸气生成一氧化碳和氢气的反应 D、煤与O2的燃烧反应3. 下列说法中正确的是( )A、在化学反应过程中,发生物质变化的同时不一定发生能量变化 B、生成物全部化学键形成时所释放的能量大于破坏反应物全部化学键所吸收的能量时,反应为吸热反应 C、反应产物的总能量大于反应物的总能量时,△H>0 D、△H的大小与热化学方程式的计量系数无关4. 已知H2(g)+Cl2(g)═2HCl(g)△H=﹣184.6kJ/mol,则反应HCl(g)═ H2(g)+ Cl2(g)的△H为( )A、+184.6kJ/mol B、﹣92.3kJ/mol C、+92.3kJ D、+92.3kJ/mol5. 已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )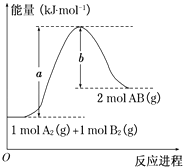 A、每生成2molAB吸收b kJ热量 B、该反应热△H=+(a﹣b)kJ•mol﹣1 C、该反应中反应物的总能量高于生成物的总能量 D、断裂1 mol A﹣A和1 mol B﹣B键,放出a kJ能量6. 已知热化学方程式:SO2(g)+ O2(g)⇌SO3(g)△H=﹣98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )A、98.32kJ B、196.64kJ/mol C、<196.64kJ D、>196.64kJ7. 下列说法正确的是( )A、甲烷燃烧热的数值为890.3kJ•mol﹣1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3kJ•mol﹣1 B、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的中和热为57.4kJ/mol C、相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H相同8. X、Y、Z、W有如下所示的转化关系,且△H=△H1+△H2 , 则X、Y可能是( )
A、每生成2molAB吸收b kJ热量 B、该反应热△H=+(a﹣b)kJ•mol﹣1 C、该反应中反应物的总能量高于生成物的总能量 D、断裂1 mol A﹣A和1 mol B﹣B键,放出a kJ能量6. 已知热化学方程式:SO2(g)+ O2(g)⇌SO3(g)△H=﹣98.32kJ/mol,在容器中充入2molSO2和1molO2充分反应,最终放出的热量为( )A、98.32kJ B、196.64kJ/mol C、<196.64kJ D、>196.64kJ7. 下列说法正确的是( )A、甲烷燃烧热的数值为890.3kJ•mol﹣1 , 则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=﹣890.3kJ•mol﹣1 B、含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的中和热为57.4kJ/mol C、相同条件下,2mol氢原子所具有的能量小于1mol氢分子所具有的能量 D、同温同压下,H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件的△H相同8. X、Y、Z、W有如下所示的转化关系,且△H=△H1+△H2 , 则X、Y可能是( )①C,CO ②S,SO2 ③AlCl3、Al(OH)3 ④Na2CO3、NaHCO3 ⑤Fe、FeCl2 .
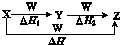 A、①②③④⑤ B、②④⑤ C、①③④ D、①②③9. 在一定条件下,氢气和丙烷完全燃烧的热化学方程式分别为2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1 , C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣2220kJ•mol﹣1.5mol氢气和丙烷的混合气体完全燃烧时放热3847kJ,则氢气和丙烷的体积比为( )A、1:3 B、3:1 C、1:4 D、1:110. 下列过程中,需要增大化学反应速率的是( )A、钢铁腐蚀 B、食物腐败 C、塑料老化 D、工业合成氨11. 反应4CO(g)+2NO2(g)⇌N2(g)+4CO2(g)开始进行时,CO的浓度为4mol/L,N2的浓度为0,2min后测得N2的浓度为0.6mol/L,则此段时间内,下列反应速率表示正确的是( )A、v(CO)=1.2 mol/(L•s) B、v(NO2)=0.3 mol/(L•min) C、v(N2)=0.6 mol/(L•min) D、v(CO2)=1.2 mol/(L•min)12. NO和CO都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化碳气体:2NO+2CO═N2+2CO2 . 对此反应,下列叙述正确的是( )A、使用催化剂能加快反应速率 B、压强增大不影响化学反应速率 C、冬天气温低,反应速率降低,对人类危害减小 D、无论外界条件怎样改变,均对此化学反应的速率无影响13. 下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是( )A、Cu能与浓硝酸反应,但不能与浓盐酸反应 B、Cu与浓硝酸反应比与稀硝酸反应快 C、N2与O2在常温、常压下不反应,放电时可反应 D、Fe与浓盐酸反应比与稀盐酸反应快14. 已知反应:2NO(g)+Br2(g)⇌2NOBr(g)的活化能为akJ•mol﹣1 , 其反应机理如下:
A、①②③④⑤ B、②④⑤ C、①③④ D、①②③9. 在一定条件下,氢气和丙烷完全燃烧的热化学方程式分别为2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1 , C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣2220kJ•mol﹣1.5mol氢气和丙烷的混合气体完全燃烧时放热3847kJ,则氢气和丙烷的体积比为( )A、1:3 B、3:1 C、1:4 D、1:110. 下列过程中,需要增大化学反应速率的是( )A、钢铁腐蚀 B、食物腐败 C、塑料老化 D、工业合成氨11. 反应4CO(g)+2NO2(g)⇌N2(g)+4CO2(g)开始进行时,CO的浓度为4mol/L,N2的浓度为0,2min后测得N2的浓度为0.6mol/L,则此段时间内,下列反应速率表示正确的是( )A、v(CO)=1.2 mol/(L•s) B、v(NO2)=0.3 mol/(L•min) C、v(N2)=0.6 mol/(L•min) D、v(CO2)=1.2 mol/(L•min)12. NO和CO都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化碳气体:2NO+2CO═N2+2CO2 . 对此反应,下列叙述正确的是( )A、使用催化剂能加快反应速率 B、压强增大不影响化学反应速率 C、冬天气温低,反应速率降低,对人类危害减小 D、无论外界条件怎样改变,均对此化学反应的速率无影响13. 下列事实能说明影响化学反应速率的决定性因素是反应物本身性质的是( )A、Cu能与浓硝酸反应,但不能与浓盐酸反应 B、Cu与浓硝酸反应比与稀硝酸反应快 C、N2与O2在常温、常压下不反应,放电时可反应 D、Fe与浓盐酸反应比与稀盐酸反应快14. 已知反应:2NO(g)+Br2(g)⇌2NOBr(g)的活化能为akJ•mol﹣1 , 其反应机理如下:①NO(g)+Br2(g)⇌NOBr2(g)慢
②NO(g)+NOBr2(g)⇌2NOBr(g)快
下列有关该反应的说法正确的是( )
A、反应速率主要取决于反应②的快慢 B、反应速率v(NO)=v(NOBr)=2v(Br2) C、NOBr2是该反应的催化剂 D、该反应的焓变等于akJ•mol﹣115. 一定温度下,对于可逆反应A2(g)+3B2(g)⇌2AB3(g)(正反应放热)的下列叙述,不能说明反应已达化学平衡状态的是( )A、恒容容器内混合气体的密度不再变化 B、AB3的生成速率与B2的生成速率之比为2:3 C、恒压容器内混合气体的总物质的量不再变化 D、单位时间内断裂a mol A≡A键,同时断裂6a mol A﹣B键16. 2mol A与2mol B混合于2L的密闭容器中反应:2A(g)+3B(g)⇌2C(g)+zD(g)若2s后,A的转化率为50%,测得v(D)=0.25mol•L﹣1•s﹣1 , 下列推断正确的是( )A、v(C)=0.2 mol•L﹣1•s﹣1 B、z=3 C、B的转化率为25% D、C的体积分数为28.6%17. 已知在25℃时,下列反应的平衡常数如下:①N2(g)+O2(g)⇌2NO(g) K1=1×10﹣30
②2H2(g)+O2(g)⇌2H2O(g) K2=2×1081
③2CO2(g)⇌2CO(g)+O2(g) K3=4×10﹣92
下列说法正确的是( )
A、NO分解反应NO(g)⇌ N2(g)+ O2(g)的平衡常数为1×10﹣30 B、根据K2的值可以判断常温下H2和O2很容易反应生成H2O C、常温下,NO,H2O,CO2三种物质分解放出O2的倾向顺序为NO>H2O>CO2 D、温度升高,上述三个反应的平衡常数均增大18. 25℃和1.01×105Pa时,反应2N2O5(g)═4NO2(g)+O2(g)△H=+56.76kJ/mol,自发进行的原因是( )A、是吸热反应 B、是放热反应 C、是熵减少的反应 D、熵增大效应大于能量效应19. 一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)⇌CO2(g)+H2(g),部分数据见下表(表中t2>t1):反应时间/min
N(CO)/mol
H2O/mol
N(CO2)/mol
N(H2)/mol
0
1.20
0.60
0
0
t1
0.80
t2
0.20
下列说法正确的是( )
A、反应在t1min内的平均速率为v(H2)= mol•L﹣1•min﹣1 B、平衡时CO的转化率为66.67% C、该温度下反应的平衡常数为1 D、其他条件不变,若起始时n(C0)=0.60 mol,n(H20)=1.20 mol,则平衡时n(C02)=0.20 mol二、解答题
-
20. 已知下列热化学方程式:
①CaCO3(s)═CaO+CO2(g)△H=+177.7kJ
②C(s)+H2O(s)═CO(g)+H2(g)△H=﹣131.3kJ•mol﹣1
③ H2SO4(1)+NaOH(1)═ Na2SO4(1)+H2O(1)△H=﹣57.3kJ•mol﹣1
④C(s)+O2(g)═CO2(g)△H=﹣393.5kJ•mol﹣1
⑤CO(g)+ O2(g)═CO2(g)△H=﹣283kJ•mol﹣1
⑥HNO3(aq)+NaOH(aq)═NaNO3(aq)+H2O(1)△H=﹣57.3kJ•mol﹣1
⑦2H2(g)+O2(g)═2H2O(1)△H=﹣517.6kJ•mol﹣1
(1)、上述热化学方程式中,不正确的有 , 不正确的理由分别是 .(2)、根据上述信息,写出C转化为CO的热化学方程式: .(3)、上述反应中,表示燃烧热的热化学方程式有;表示中和热的热化学方程式有21. 将氧化铁还原为铁的技术在人类文明的进步中占有十分重要的地位.炼铁高炉中发生的关键反应如下:C(s)+O2(g)═CO2(g)△H=﹣393.5kJ/mol
CO2(g)+C(s)═2CO(g)△H=+172.46kJ/mol
Fe2O3+CO→Fe+CO2
若已知:2Fe(s)+ O2(g)═Fe2O3(s)△H=﹣824.21kJ/mol
根据上面三个热化学方程式,回答下列问题:
(1)、CO的燃烧热为;写出其热化学方程式 .(2)、高炉内Fe2O3被CO还原为Fe的热化学方程式为 .(3)、炼制1t(吨)含铁96%的生铁所需焦炭的理论用量是 t(结果保留两位有效数字),实际生产中所需焦炭远高于理论用量,其原因是 .22. 用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: (1)、从实验装置上看,图中尚缺少的一种玻璃用品是 .(2)、烧杯间填满碎纸条的作用是 .(3)、大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)(4)、如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由(5)、用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”).23. 在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,发生反应:SO2(g)+NO2(g)⇌SO3(g)+NO(g).当达到平衡状态时,测得容器中SO2(g)的转化率为50%.
(1)、从实验装置上看,图中尚缺少的一种玻璃用品是 .(2)、烧杯间填满碎纸条的作用是 .(3)、大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)(4)、如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由(5)、用相同浓度和体积的氨水(NH3•H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”).23. 在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,发生反应:SO2(g)+NO2(g)⇌SO3(g)+NO(g).当达到平衡状态时,测得容器中SO2(g)的转化率为50%.试求:该温度下、该容器中,再继续加入1mol的SO2(g),则:
(1)、化学平衡将向方向移动,NO2的转化率将(填“增大”、“不变”或“减小”);(2)、经计算,当达到新的平衡状态时,容器中SO2(g)的浓度是 mol/L;(3)、整个过程中,SO2的转化率由50%变为 %,NO2的转化率由 %变为 %.(4)、计算结果给我们的启示是:增大一种反应物物的用量,其转化率将(填“增大”、“不变”或“减小”)另一反应物的转化率将(填“增大”、“不变”或“减小”).现实生产中的意义是:可以通过增大的用量,来提高成本高的反应物的利用率.24. 工业上通常采用CO(g)和H2(g)催化合成甲醇CH3OH(g).(1)、在一定温度和压强下,CO(g)+2H2(g)⇌CH3OH(g)△H=﹣128.8kJ/mol.若将10a mol CO和20a mol H2放入2L的密闭容器中,充分反应后测得CO的转化率为60%,则该反应的平衡常数为(用含a的代数式表示).若此时再向该容器中投入10a mol CO,20a mol H2和10a mol CH3OH(g),判断平衡移动的方向是(填“正向移动”、“逆向移动”或“不移动”);
与原平衡相比,CO的物质的量浓度(填“增大”、“不变”或“减小”).
(2)、判断该反应达到平衡状态的依据是 (填字母序号).A、混合气体的密度不变 B、混合气体的平均相对分子质量不变 C、2v逆(H2)=v正(CO) D、容器内CO,H2、CH3OH的浓度之比为1:2:1 E、CH3OH,CO,H2的浓度都不再发生变化(3)、一定条件下,在容积相同的三个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如表:容器
甲
乙
丙
反应物投入量
1 mol CO、
2 mol H2
1 mol CH3OH
2 mol CH3OH
平衡
时数
据
反应能量变化的绝对值(kJ)
a
b
c
反应物转化率
α1
α2
α3
则a+b=;a1+a3(填“<”、“>”或“=”,).
25. 某研究小组向某2L密闭容器中加入一定量的固体A和气体B,发生反应A(s)+2B(g)⇌D(g)+E(g)△H=QkJ•mol﹣1 . 在T1℃时,反应进行到不同时间测得各物质的物质的量如下表:时间(min)
0
10
20
30
40
50
B
2.00
1.36
1.00
1.00
1.20
1.20
D
0
0.32
0.50
0.50
0.60
0.60
E
0
0.32
0.50
0.50
0.60
0.60
(1)、T1℃时,该反应的平衡常数K=;(2)、30min后,只改变某一条件,反应重新达到平衡,根据表中的数据判断改变的条件可能是(填字母编号).a.通入一定量的B
b.加入一定量的固体A
c.适当缩小容器的体积
d.升高反应体系温度
e.同时加入0.2molB、0.1molD,0.1molE
(3)、对于该反应,用各物质表示的反应速率与时间的关系示意曲线为如图中的(填序号)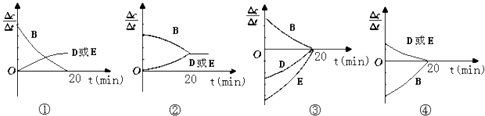 (4)、维持容器的体积和温度T1不变,当向该容器中加入1.60molB,0.20molD,0.20molE和nmolA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n取值范围 mol.(5)、维持容器的体积和温度T1不变,各物质的起始物质的量为:n(A)=1.0mol,n(B)=3.0mol,n(D)=amol,n(E)=0mol,达到平衡后,n(E)=0.50mol,则a= .(6)、若该密闭容器绝热,实验测得B的转化率B%随时间变化的示意图如图所示由图可知,Q0(填“大于”或“小于”),c点v正 v逆(填“大于”、“小于”或“等于”.)
(4)、维持容器的体积和温度T1不变,当向该容器中加入1.60molB,0.20molD,0.20molE和nmolA,达到平衡后,与表格中20分钟时各物质的浓度完全相同时,则投入固体A的物质的量n取值范围 mol.(5)、维持容器的体积和温度T1不变,各物质的起始物质的量为:n(A)=1.0mol,n(B)=3.0mol,n(D)=amol,n(E)=0mol,达到平衡后,n(E)=0.50mol,则a= .(6)、若该密闭容器绝热,实验测得B的转化率B%随时间变化的示意图如图所示由图可知,Q0(填“大于”或“小于”),c点v正 v逆(填“大于”、“小于”或“等于”.)