2016-2017学年山东省菏泽市高二上学期期中化学试卷(b)
试卷更新日期:2017-01-17 类型:期中考试
一、选择题
-
1. 下列反应既是吸热反应,又是氧化还原反应的是( )A、甲烷在O2中燃烧的反应 B、Ba(OH)2•8H2O与NH4Cl的反应 C、灼热的碳与H2O(g)反应 D、铝片与稀H2SO4反应2. 在相同条件下,下面各组热化学方程式中,△H1>△H 2的是( )A、2H2(g)+O2(g)=2H2O(L);△H1 2H2(g)+O2(g)=2H2O(g);△H2 B、S(g)+O2(g)=SO2(g);△H1 S(s)+O2(g)=SO2(g)△H2 C、H2(g)+Cl2(g)=2HCl(g);△H1 H2(g)+ Cl2(g)=HCl(g);△H2 D、C(s)+ O2(g)=CO(g);△H1 C(s)+O2(g)=CO2(g);△H23. 下列有关化学反应速率的叙述中,正确的是( )A、100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 B、用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 C、汽车尾气中的CO和NO可以缓慢反应生成N2和CO2 , 加入催化剂,不影响CO的转化率 D、二氧化硫的催化氧化是一个放热反应,升高温度,平衡逆向移动,正反应速率减慢4. 如图的烧杯中盛的都是海水,铁在其中被腐蚀的速率由快到慢的顺序为( )
 A、③④②① B、③④①② C、④②①③ D、②①③④5. 在298K和101KPa时,2N2O5(g)=4NO2(g)+O2(g);△H=+56.7kJ/mol,能自发进行的合理解释是( )A、是熵减反应 B、是熵增效应大于能量效应 C、是吸热反应 D、是放热反应6. 如图是198K时N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( )
A、③④②① B、③④①② C、④②①③ D、②①③④5. 在298K和101KPa时,2N2O5(g)=4NO2(g)+O2(g);△H=+56.7kJ/mol,能自发进行的合理解释是( )A、是熵减反应 B、是熵增效应大于能量效应 C、是吸热反应 D、是放热反应6. 如图是198K时N2与H2反应过程中能量变化的曲线图,下列叙述正确的是( ) A、该反应的热化学方程式为N2+3H2⇌2NH3△H=﹣92 kJ•mol﹣1 B、a曲线是加入催化剂时的能量变化曲线 C、加入催化剂,该化学反应的反应热改变 D、升高温度,反应速率加快7. 将10℃的0.2mol N2O4置于2L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)⇌2NO2 (g).下列结论能说明上述反应在该条件下已经达到平衡状态的是( )
A、该反应的热化学方程式为N2+3H2⇌2NH3△H=﹣92 kJ•mol﹣1 B、a曲线是加入催化剂时的能量变化曲线 C、加入催化剂,该化学反应的反应热改变 D、升高温度,反应速率加快7. 将10℃的0.2mol N2O4置于2L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)⇌2NO2 (g).下列结论能说明上述反应在该条件下已经达到平衡状态的是( )①烧瓶内气体的平均相对分子质量不再变化
②NO2的物质的量浓度不再改变
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤烧瓶内气体的颜色不再加深
⑥N2O4的消耗速率与NO2的生成速率之比为1:2
⑦NO2生成速率与NO2消耗速率相等
⑧烧瓶内气体的密度不再变化.
A、①②③⑤⑦ B、①②③⑤⑥⑦ C、①②③④ D、②③⑦⑧8. 一定温度下,在密闭容器中进行反应:4A(s )+3B(g)⇌2C(g)+D(g),经2min,B的浓度减少0.6mol•L﹣1 . 对此反应的反应速率的表示,正确的是( )①在2min末的反应速率,用B表示是0.3mol•L﹣1•min﹣1
②反应的过程中,只增加A的量,反应速率不变
③用A表示的反应速率是0.4mol•L﹣1•min﹣1
④分别用B、C、D表示的反应速率其比值为3:2:1.
A、①② B、③ C、① D、②④9. 在四个不同的容器中进行化学反应4A(g)+5B(g)⇌4C(g)+6D(g),以下是在不同容器中分别用不同物质表示的化学反应速率,所表示反应速率最快的( )A、v (A)=0.36mol•L﹣1•s﹣1 B、v (B)=0.55mol•L﹣1•s﹣1 C、v (C)=0.40mol•L﹣1•s﹣1 D、v (D)=0.48mol•L﹣1•s﹣110. 某温度下,将浓度都是0.1mol•L﹣1的X2、Y2两种气体充入至密闭容器中,使之发生反应生成气体Z,达到平衡时c(X2)=0.04mol•L﹣1、c(Y2)=0.08mol•L﹣1、c(Z)=0.04mol•L﹣1 , 则该反应的反应式是( )A、X2+2Y2⇌XY2 B、3X2+Y2⇌2X3Y C、2X2+Y2⇌2X2Y D、X2+3Y2⇌2XY311. 下列事实中,不能用勒夏特列原理解释的是( )A、对2HI(g)⇌H2(g)+I2(g)平衡体系增加压强使颜色变深 B、反应CO(g)+NO2(g)⇌CO2(g)+NO(g)△H<0升高温度使平衡向逆方向移动 C、合成氨反应:N2(g)+3H2(g)⇌2NH3(g)△H<0,为使氨的产率提高,理论上应采取低温高压的措施 D、在溴水中存在如下平衡:Br2(g)+H2O(l)⇌HBr(aq)+HBrO(aq),当加入NaOH溶液后颜色变浅12. 有关化学平衡常数(K)的说法中不正确的是( )A、一般地说,K>105时,该反应进行得就基本完全了 B、对一个确定的反应,K值越大,正反应进行的程度越大 C、在温度一定时,K与反应物或生成物的浓度变化无关 D、温度越高,K值越大13. 下面有关电化学的图示,完全正确的是( )A、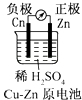 B、
B、 C、
C、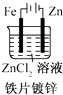 D、
D、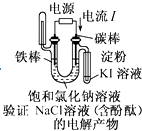 14. 将 4mol A 气体和 2mol B 气体在 2L 的密闭容器中混合并在一定条件下发生如下反应 2A(g)+B(g)⇌2C(g)△H<0. 4s后反应达到平衡状态,此时测得 C 的浓度为0.6mol•L﹣1 . 下列说法中正确的是( )A、4 s(秒)时B的浓度为0.3 mol•L﹣1 B、4s内用物质A表示的反应速率为0.075 mol•L﹣1•s﹣1 C、达平衡后B的转化率为30% D、达平衡后若通入一定量氦气,A的转化率降低15. 获得中科院“百人计划”和“863”计划支持的环境友好型铝碘电池是以AlI3溶液为电解质溶液,以金属铝和附有碘单质的石墨为电极形成的原电池.已知电池总反应为2Al+3I2═2AlI3 . 下列说法不正确的是( )A、电池工作时,溶液中的铝离子向正极移动 B、该电池可能是一种可充电的二次电池 C、消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多 D、该电池负极的电极反应为:Al﹣3e﹣═Al3+16. 恒容密闭容器中存在下列平衡:CO(g)+H2O(g)⇌CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( )
14. 将 4mol A 气体和 2mol B 气体在 2L 的密闭容器中混合并在一定条件下发生如下反应 2A(g)+B(g)⇌2C(g)△H<0. 4s后反应达到平衡状态,此时测得 C 的浓度为0.6mol•L﹣1 . 下列说法中正确的是( )A、4 s(秒)时B的浓度为0.3 mol•L﹣1 B、4s内用物质A表示的反应速率为0.075 mol•L﹣1•s﹣1 C、达平衡后B的转化率为30% D、达平衡后若通入一定量氦气,A的转化率降低15. 获得中科院“百人计划”和“863”计划支持的环境友好型铝碘电池是以AlI3溶液为电解质溶液,以金属铝和附有碘单质的石墨为电极形成的原电池.已知电池总反应为2Al+3I2═2AlI3 . 下列说法不正确的是( )A、电池工作时,溶液中的铝离子向正极移动 B、该电池可能是一种可充电的二次电池 C、消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多 D、该电池负极的电极反应为:Al﹣3e﹣═Al3+16. 恒容密闭容器中存在下列平衡:CO(g)+H2O(g)⇌CO2(g)+H2(g).CO2(g)的平衡物质的量浓度c(CO2)与温度T的关系如图所示.下列说法错误的是( ) A、在T2时,若反应进行到状态D,则一定有v正<v逆 B、平衡状态A与C相比,平衡状态A的c(CO)小 C、若T1、T2时的平衡常数分别为K1、K2 , 则K1<K2 D、反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的△H>0
A、在T2时,若反应进行到状态D,则一定有v正<v逆 B、平衡状态A与C相比,平衡状态A的c(CO)小 C、若T1、T2时的平衡常数分别为K1、K2 , 则K1<K2 D、反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的△H>0二、填空题
-
17. 现在和将来的社会,对能源和材料的需求是越来越大,我们学习化学就为了认识物质,创造物质,开发新能源,发展人类的新未来.请解决以下有关能源的问题:(1)、未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A、①②③④ B、⑤⑥⑦⑧ C、③⑤⑥⑦⑧ D、③④⑤⑥⑦⑧(2)、运动会上使用的火炬的燃料一般是丙烷(C3H8),请根据完成下列题目.①已知11g丙烷(C3H8)在298K和101Kpa条件下完全燃烧生成CO2和液态水时放出的热量为555kJ,请写出丙烷燃烧热的热化学方程式:;
②以丙烷(C3H8)和空气为原料,稀硫酸为电解质溶液(填能或不能)设计成电池!
若能,则写出通入丙烷(C3H8)的那一极为:极;氧气在极发生反应.若不能,则理由是
③丙烷在一定条件下发生脱氢反应可以得到丙烯.
已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ•mol﹣1
CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJ•mol﹣1
则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=
(3)、已知:H﹣H键的键能为436KJ/mol,H﹣N键的键能为391KJ/mol,根据化学方程式:N2+3H2⇌2NH3△H=﹣92.4KJ/mol,①请计算出N≡N键的键能为 .
②若向处于上述热化学方程式相同温度和体积一定的容器中,通入1mol N2 和3mol H2 , 充分反应后,恢复原温度时放出的热量 92.4KJ(填大于或小于或等于).
18. 如图是一个化学过程的示意图.请根据该示意图完成下列题目: (1)、请问:甲池是装置,乙池是装置.(2)、在甲池中:通入C2H4的电极名称是 , 通入O2的电极的电极反应式是 . 甲池中发生的反应的化学方程式为 .(3)、在乙池中:B(石墨)电极的名称是 , A(Fe)电极的电极反应式为 .(4)、乙池中反应的化学方程式为 .(5)、当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2mL(标准状况下)19. 830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H>0
(1)、请问:甲池是装置,乙池是装置.(2)、在甲池中:通入C2H4的电极名称是 , 通入O2的电极的电极反应式是 . 甲池中发生的反应的化学方程式为 .(3)、在乙池中:B(石墨)电极的名称是 , A(Fe)电极的电极反应式为 .(4)、乙池中反应的化学方程式为 .(5)、当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2mL(标准状况下)19. 830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H>0试回答下列问题:
(1)、请写出该化学反应的平衡常数表达式: .(2)、830K温度下,若起始时c(CO)=2mol•L﹣1 , c(H2O)=3mol•L﹣1 , 达到平衡时CO的转化率为50%,则在该温度下,该反应的平衡常数K= .(3)、若降低温度,该反应的K值将 , 该反应的正反应速率将; 该反应的逆反应速率将(均填“增大”“减小”或“不变”).(4)、若要提高CO的转化率,可采取的措施有: .(5)、830K温度下,若起始时c(CO)=1mol•L﹣1 , c(H2O)=2mol•L﹣1 , 反应进行一段时间后,测得H2的浓度为0.5mol•L﹣1 , 则此时该反应是否达到平衡状态(填“是”与“否”),你判断的依据是20. 在100℃时,将0.200mol的四氧化二氮气体充入2L抽空的密闭容器中,每隔一定时间对该容器内的物质进行分析,得到如下表格:时间(S)
0
20
40
60
80
100
n(N2O4) mol
0.200
c1
0.10
c3
a
b
n(NO2) mol
0.000
0.120
c2
0.240
0.240
0.240
试填空:
(1)、该反应的化学方程式为 ,(2)、达到平衡时四氧化二氮的转化率为 .(3)、20s时四氧化二氮的浓度c1=mol•L﹣1 ,(4)、在0~20s时间段内,二氧化氮的平均反应速率为 .