2016-2017学年江西省宜春三中高二上学期期中化学试卷
试卷更新日期:2017-01-17 类型:期中考试
一、单项选择题
-
1. 下列叙述正确的是( )A、物质燃烧都是吸热反应 B、化学反应总是伴随着能量的变化 C、化学反应中需要加热的反应一定是吸热反应 D、化学反应中放出的热量就是反应热2. 如图所表示的反应是吸热反应的是( )A、
 B、
B、 C、
C、 D、
D、 3. 下列热方程式书写正确的是( )A、2SO2+O2=2SO3△H=﹣196.6 kJ/mol B、2H2(g)+O2(g)=2H2O(l)△H=﹣517.6 kJ/mol C、H2(g)+ O2(g)=H2O(l)△H=﹣285.8 kJ D、C(s)+O2(g)=CO2(g)△H=+393.5 kJ/mol4. 下列热化学方程式中,△H能正确表示物质的燃烧热的是( )A、CO(g)+ O2(g)═CO2(g);△H=﹣283.0 kJ/mol B、C(s)+ O2(g)═CO(g);△H=﹣110.5 kJ/mol C、H2(g)+ O2(g)═H2O(g);△H=﹣241.8 kJ/mol D、2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l);△H=﹣11036 kJ/mol5. 某一反应物的浓度是2mol•L﹣1 , 经过4min后,它的浓度变成1.68mol•L﹣1 , 则在这4min内它的平均反应速率为( )A、0.2 mol•L﹣1min﹣1 B、0.1 mol•L﹣1 min﹣1 C、0.04 mol•L﹣1 min﹣1 D、0.08 mol•L﹣1 min﹣16. 下列四种X溶液,均能跟盐酸反应,其中反应最快的是( )A、20℃20mL 3mol/L的X溶液 B、20℃10mL 4mol/L的X溶液 C、20℃30mL 2mol/L的X溶液 D、10℃20mL 4mol/L的X溶液7. 设C+CO2⇌2CO△H>0 反应速率为υ1 , N2+3H2⇌2NH3△H<0 反应速率为υ2 , 对于上述反应,当温度升高时,υ1和υ2的变化情况为( )A、同时增大 B、同时减小 C、增大,减小 D、减小,增大8. 对于任何一个平衡体系,采取下列措施后,一定会使平衡移动的是( )A、加入一种反应物 B、对平衡体系加压 C、升高温度 D、使用催化剂9. 反应X(g)+Y(g)⇌2Z(g)△H<0,达到平衡时,下列说法正确的是( )A、增大压强,平衡向右移动 B、加入催化剂,Z的产率增大 C、增大c(X),X的转化率增大 D、降低温度,Y的转化率增大10. 在一定温度不同压强(P1>P2)下,可逆反应2X(g)⇌2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(Z%)与反应时间(t)的关系有以下图示,正确的是( )A、
3. 下列热方程式书写正确的是( )A、2SO2+O2=2SO3△H=﹣196.6 kJ/mol B、2H2(g)+O2(g)=2H2O(l)△H=﹣517.6 kJ/mol C、H2(g)+ O2(g)=H2O(l)△H=﹣285.8 kJ D、C(s)+O2(g)=CO2(g)△H=+393.5 kJ/mol4. 下列热化学方程式中,△H能正确表示物质的燃烧热的是( )A、CO(g)+ O2(g)═CO2(g);△H=﹣283.0 kJ/mol B、C(s)+ O2(g)═CO(g);△H=﹣110.5 kJ/mol C、H2(g)+ O2(g)═H2O(g);△H=﹣241.8 kJ/mol D、2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l);△H=﹣11036 kJ/mol5. 某一反应物的浓度是2mol•L﹣1 , 经过4min后,它的浓度变成1.68mol•L﹣1 , 则在这4min内它的平均反应速率为( )A、0.2 mol•L﹣1min﹣1 B、0.1 mol•L﹣1 min﹣1 C、0.04 mol•L﹣1 min﹣1 D、0.08 mol•L﹣1 min﹣16. 下列四种X溶液,均能跟盐酸反应,其中反应最快的是( )A、20℃20mL 3mol/L的X溶液 B、20℃10mL 4mol/L的X溶液 C、20℃30mL 2mol/L的X溶液 D、10℃20mL 4mol/L的X溶液7. 设C+CO2⇌2CO△H>0 反应速率为υ1 , N2+3H2⇌2NH3△H<0 反应速率为υ2 , 对于上述反应,当温度升高时,υ1和υ2的变化情况为( )A、同时增大 B、同时减小 C、增大,减小 D、减小,增大8. 对于任何一个平衡体系,采取下列措施后,一定会使平衡移动的是( )A、加入一种反应物 B、对平衡体系加压 C、升高温度 D、使用催化剂9. 反应X(g)+Y(g)⇌2Z(g)△H<0,达到平衡时,下列说法正确的是( )A、增大压强,平衡向右移动 B、加入催化剂,Z的产率增大 C、增大c(X),X的转化率增大 D、降低温度,Y的转化率增大10. 在一定温度不同压强(P1>P2)下,可逆反应2X(g)⇌2Y(g)+Z(g)中,生成物Z在反应混合物中的体积分数(Z%)与反应时间(t)的关系有以下图示,正确的是( )A、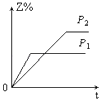 B、
B、 C、
C、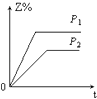 D、
D、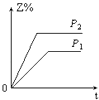 11. 下列关于平衡常数K的说法中,正确的是( )A、在任何条件下,化学平衡常数是一个恒定值 B、改变反应物浓度或生成物浓度都会改变平衡常数K C、平衡常数K只与温度有关,与反应浓度、压强无关 D、从平衡常数K的大小不能推断一个反应进行的程度12. 水溶液中下列电离方程式书写正确的是( )A、Ca(OH)2⇌Ca2++2OH﹣ B、NaHCO3═Na++H++CO32﹣ C、H2CO3⇌2H++CO32﹣ D、Na2SO4═2Na++SO42﹣13. 区分强电解质和弱电解质的依据是( )A、溶解度的大小 B、属于离子化合物还是共价化合物 C、是否存在电离平衡 D、导电性的强弱14. 下列说法中正确的是( )A、HCl溶液中无OH﹣ B、NaOH溶液中无H+ C、NaCl溶液中既无OH﹣也无H+ D、常温下,任何物质的水溶液中都有H+和OH﹣ , 且KW=c(H+)•c(OH﹣)=10﹣1415. 下列关于电离常数的说法正确的是( )A、电离常数随着弱电解质的浓度增大而增大 B、CH3COOH的电离常数表达式为Ka= C、CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小 D、电离常数只与温度有关,与浓度无关16. 常温下,将10mL pH=1的CH3COOH溶液加水稀释至100mL后,溶液中的pH值为( )A、2 B、2<pH<7 C、1<pH<2 D、无法判读
11. 下列关于平衡常数K的说法中,正确的是( )A、在任何条件下,化学平衡常数是一个恒定值 B、改变反应物浓度或生成物浓度都会改变平衡常数K C、平衡常数K只与温度有关,与反应浓度、压强无关 D、从平衡常数K的大小不能推断一个反应进行的程度12. 水溶液中下列电离方程式书写正确的是( )A、Ca(OH)2⇌Ca2++2OH﹣ B、NaHCO3═Na++H++CO32﹣ C、H2CO3⇌2H++CO32﹣ D、Na2SO4═2Na++SO42﹣13. 区分强电解质和弱电解质的依据是( )A、溶解度的大小 B、属于离子化合物还是共价化合物 C、是否存在电离平衡 D、导电性的强弱14. 下列说法中正确的是( )A、HCl溶液中无OH﹣ B、NaOH溶液中无H+ C、NaCl溶液中既无OH﹣也无H+ D、常温下,任何物质的水溶液中都有H+和OH﹣ , 且KW=c(H+)•c(OH﹣)=10﹣1415. 下列关于电离常数的说法正确的是( )A、电离常数随着弱电解质的浓度增大而增大 B、CH3COOH的电离常数表达式为Ka= C、CH3COOH溶液中加入少量CH3COONa溶液,电离常数减小 D、电离常数只与温度有关,与浓度无关16. 常温下,将10mL pH=1的CH3COOH溶液加水稀释至100mL后,溶液中的pH值为( )A、2 B、2<pH<7 C、1<pH<2 D、无法判读二、填空题
-
17. 1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH发生中和反应的中和热为 , 表示该中和热的热化学方程式为 .18. 向1L1mol/L的NaOH溶液中加入下列物质:①浓H2SO4;②稀硝酸;③稀醋酸,恰好完全反应的热效应△H1、△H2、△H3的大小关系为 .19. 已知下列反应的反应热:
①CH3COOH(l)+2O2(g)=2CO2 (g)+2H2O(l)△H=﹣870.3kJ∕mol
②C(S)+O2(g)=CO2 (g)△H=﹣393.5kJ∕mol
③2C(S)+2H2(g)+O2(g)=CH3COOH(l)△H=﹣488.3kJ∕mol
请写出H2燃烧热的热化学方程式 .
20. 2A⇌B+C在某一温度时,达到平衡.(1)、若温度升高,平衡向正反应方向移动,则正反应是反应(填放热或吸热);(2)、若B为固体,降低压强平衡向逆反应方向移动,则A呈态;(3)、若A是气态时,加压时,平衡不移动,则B为态,C为态;(4)、若A、B、C均为气体,加入催化剂,平衡移动(填正向、逆向、不)21. 在2L密闭容器内,800℃时反应:2NO(g)+O2(g)⇌2NO2(g)体系中,n(NO)随时间的变化如表:时间(s)
0
1
2
3
4
n(NO)(mol)
0.020
0.01
0.008
0.007
0.007
(1)、写出该反应的平衡常数表达式:K=;若其他条件不变,容器体积缩小为1L,则K值 . (增大、减小或不变);若K300°C>K350°C , 则该反应是热反应.(2)、用O2表示从0~2s内该反应的平均速率v=;(3)、能说明该反应已达到平衡状态的是a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)、为使该反应的反应速率增大,且平衡向正反应方向移动的是a.及时分离除NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂.