2016-2017学年湖北省部分重点中学高二上学期期中化学试卷
试卷更新日期:2017-01-16 类型:期中考试
一、单选题
-
1. 新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生.下列属于新能源的是( )
①太阳能 ②天然气 ③地热能④煤 ⑤生物质能⑥石油 ⑦风能 ⑧氢能.
A、①②③⑦⑧ B、①③⑤⑦⑧ C、①③⑤⑧ D、②④⑤⑥⑦2. 下列说法正确的是( )A、放热反应在常温下都很容易发生 B、吸热反应不加热就不会发生 C、需要加热才能发生的反应都是吸热反应 D、根据反应物和生成物具有总能量的相对大小可确定反应热3. 对于一定不能自发进行的反应来说,反应后体系的( )A、混乱度增大,而能量降低 B、混乱度降低,而能量增大 C、混乱度降低,而能量降低 D、混乱度增大,而能量增大4. 下列说法正确的是( )A、物质发生化学变化一定伴随着能量变化 B、升高温度或加入催化剂,可以改变化学反应的反应热 C、据能量守恒定律,反应物的总能量一定等于生成物的总能量 D、热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的5. 下列关于强弱电解质的说法,错误的是( )A、强电解质在溶液中完全电离,不存在电离平衡 B、纯净的强电解质在液态时,有的导电,有的不导电 C、同一弱电解质的溶液,当温度、浓度不同时,其导电能力也不同 D、在溶液中,导电能力强的电解质为强电解质,导电能力弱的电解质是弱电解质6. 用标准浓度的盐酸来滴定锥形瓶中放置时间较长的氢氧化钠溶液,应选用的指示剂及滴定终点颜色变化的情况最好是( )A、石蕊,由蓝变红 B、酚酞,红色褪去 C、甲基橙,由黄变橙 D、甲基橙,由橙变黄7. 下列措施能明显增大原反应的化学反应速率的是( )A、恒温恒容条件下,在工业合成氨反应中,增加氮气的量 B、将稀硫酸改为98%的浓硫酸与Zn反应制取H2 C、在H2SO4与NaOH两溶液反应时,增大压强 D、Na与水反应时增大水的用量8. 氨气和氧气在某催化剂和不同温度下生成的产物如图所示.已知在800℃下,容积固定的密闭容器中发生反应①、②:4NH3(g)+3O2(g) 2N2(g)+6H2O(g) ①
4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ②
下列描述可说明两反应均达到平衡的是( )
 A、v(N2)=v(NO) B、反应①的焓变△H保持恒定 C、体系的密度不再发生变化 D、混合气体的平均相对分子质量不再发生变化9. 某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A,B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )A、均减半 B、均加倍 C、均增加1mol D、均减少1mol10. 在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0,下列对图象的分析中不正确的是( )
A、v(N2)=v(NO) B、反应①的焓变△H保持恒定 C、体系的密度不再发生变化 D、混合气体的平均相对分子质量不再发生变化9. 某温度下,在一容积可变的容器中,反应2A(g)+B(g)⇌2C(g)达到平衡时,A,B和C的物质的量分别为4mol、2mol和4mol.保持温度和压强不变,对平衡混合物中三者的物质的量做如下调整,可使平衡右移的是( )A、均减半 B、均加倍 C、均增加1mol D、均减少1mol10. 在容积可变的密闭容器中存在如下反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0,下列对图象的分析中不正确的是( ) A、图Ⅰ研究的是t0时升高温度对反应速率的影响 B、图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 C、图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 D、图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高11. 某温度下,反应:2A(g)⇌B(g)+C(g)的平衡常数为1,在容积为2L的密闭容器中加入A(g),20s时测得各组分的物质的量如下表:下列说法正确的是( )
A、图Ⅰ研究的是t0时升高温度对反应速率的影响 B、图Ⅱ研究的是t0时增大压强(缩小体积)或使用催化剂对反应速率的影响 C、图Ⅲ研究的是催化剂对化学平衡的影响,且甲使用了催化剂 D、图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高11. 某温度下,反应:2A(g)⇌B(g)+C(g)的平衡常数为1,在容积为2L的密闭容器中加入A(g),20s时测得各组分的物质的量如下表:下列说法正确的是( )物质
A(g)
B(g)
C(g)
物质的量/mol
1.2
0.6
0.6
A、反应前20 s内的平均反应速率为v(A)=0.6 mol•L﹣1•s﹣1 B、20 s时,正反应速率大于逆反应速率 C、达到平衡时,A(g)的转化率为100% D、若升高温度平衡常数变为2,则反应的△H<012. 在甲烧杯中放入盐酸,乙烧杯中放入某一元酸HA,两种溶液的体积和pH都相等,向两烧杯中同时加入质量不等的锌粒,反应结束后得到等量的氢气,则下列事实或叙述能说明一元酸HA是弱酸的是( )A、两烧杯中参加反应的锌粒等量 B、反应开始时产生H2的速率相等 C、反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)大 D、甲烧杯中放入锌的质量一定比乙烧杯中放入锌的质量大13. 90℃时水的离子积KW=3.8×10﹣13 , 该温度时纯水的pH是( )A、等于7 B、小于7 C、大于7 D、无法确定14. 常温下某溶液中,由水电离出的c(H+)为1×10﹣12mol/L,该溶液中一定能大量共存的离子组是( )A、K+、Na+、SO42﹣、NO3﹣ B、Na+、K+、ClO﹣、CO32﹣ C、Fe2+、Mg2+、Cl﹣、SO42﹣ D、NH4+、Cl﹣、K+、SO32﹣15. 将pH=1的盐酸平均分成2份,1份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为( )A、9:1 B、10:1 C、11:1 D、12:116. 某温度下,液氨的离子积常数K=c(NH4+)•c(NH2﹣)=1.6×10﹣29 , 若用定义pH一样来规定pN=﹣lg c(NH4+),则在该温度下,下列叙述正确的是( )A、纯净的液氨中,pN=7 B、纯净的液氨中,c(NH4+)•c(NH2﹣)>1.0×10﹣14 C、1 L溶解有0.001 mol NH4Cl的液氨溶液,其pN=3 D、1 L溶解有0.001 mol NaNH2的液氨溶液,其pN=11二、非选择题
-
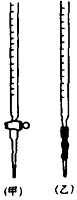
17. 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
 (1)、从实验装置上看,图中尚缺少的一种玻璃用品是;(2)、用相同浓度和体积的醋酸代替稀盐酸溶液进行实验,求得的中和热数值(填“偏 大”、“偏小”或“无影响”);(3)、实验中改用60mL 0.50mol/L 盐酸跟50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由 .18. ①如图Ⅰ表示10mL量筒中液面的位置.A与B,B与C刻度间相差1mL,如果刻度A为6,量筒中液体的体积是mL.
(1)、从实验装置上看,图中尚缺少的一种玻璃用品是;(2)、用相同浓度和体积的醋酸代替稀盐酸溶液进行实验,求得的中和热数值(填“偏 大”、“偏小”或“无影响”);(3)、实验中改用60mL 0.50mol/L 盐酸跟50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等”或“不相等”),所求中和热(填“相等”或“不相等”),简述理由 .18. ①如图Ⅰ表示10mL量筒中液面的位置.A与B,B与C刻度间相差1mL,如果刻度A为6,量筒中液体的体积是mL.②图Ⅱ表示50mL滴定管中液面的位置.如果液面处的 读数是a,则滴定管中液体的体积(填代号) .
A.是a mL B.一定大于a mL
C.是(50﹣a) mL D.一定大于(50﹣a) mL.
 19. 已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化:
19. 已知KMnO4、MnO2在酸性条件下均能将草酸 (H2C2O4)氧化:( i)MnO4﹣+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)
( ii)MnO2+H2C2O4+2H+=Mn2++2CO2↑+2H2O
某研究小组为测定某软锰矿中MnO2的质量分数,准确称取1.20g软锰矿样品,加入1.80g草酸,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应之后冷却、滤去杂质,将所得溶液转移到容量瓶中并定容;从中取出25.00mL待测液置于锥形瓶中,再用0.020mol•L﹣1KMnO4标准溶液进行滴定,当滴入20.00mLKMnO4溶液时恰好完全反应.试回答下列问题:
①方程式( i)配平后H2C2O4的计量系数为 .
②0.020mol•L﹣1KMnO4标准溶液应置于(填“甲”或“乙”)滴定管中;滴定终点的颜色变化是 .
③你能否帮助该研究小组求得软锰矿中MnO2的质量分数;若“能”,请给出计算结果;若“否”,试说明原因.“能”的计算结果或“否”的原因说明 .
④若在实验过程中存在下列操作,其中会使所测MnO2的质量分数偏小的是 .
A.滴定前尖嘴部分有一气泡,滴定终点时消失
B.溶液转移至容量瓶中,未将烧杯、玻棒洗涤
C.滴定前仰视读数,滴定后俯视读数
D.定容时,俯视刻度线
E.锥形瓶水洗之后未用待测液润洗.
 20. 根据中学化学常见的①CH3COOH;②HCl;③H2SO4三种溶液,请用A,B,C…等符号填空:A.①<②<③B.①=②=③C.①>②>③D.①<②=③
20. 根据中学化学常见的①CH3COOH;②HCl;③H2SO4三种溶液,请用A,B,C…等符号填空:A.①<②<③B.①=②=③C.①>②>③D.①<②=③E.①=③>②F.①>②=③G.①=②>③H.①=②<③
(1)、当它们pH相同时,其物质的量浓度关系是 .(2)、当它们的物质的量浓度相同时,其pH的关系是 .(3)、中和等体积、等物质的量浓度的烧碱溶液,需同物质的量浓度的三种酸溶液的体积关系为 .(4)、当它们pH相同、体积相同时,同时加入锌,则开始时反应速率 , 若产生相同体积的气体(相同状况),所需时间 .(5)、将pH相同的三种酸均稀释10倍后,pH关系为 .21. 甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的一种原理是CH3OH(g)和H2O(g)反应生成CO2和H2 . 图是该过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,正反应活化能 a的变化是(填“增大”、“减小”、“不变”),反应热△H的变 化是(填“增大”、“减小”、“不变”).请写出反应进程CH3OH(g)和H2O(g)反应的热化学方程式 . 22. 氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体.
22. 氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体.已知:①CO(g)+NO2(g)═NO(g)+CO2(g)△H=﹣akJ•mol﹣1(a>0)
②2CO(g)+2NO(g)═N2(g)+2CO2(g)△H=﹣bkJ•mol﹣1(b>0)
若用标准状况下4.48L CO还原NO2至N2(CO完全反应),整个过程中转移电子的物质的量为 , 放出的热量为kJ(用含有a和b的代数式表示).
23. 在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2 , 发生的反应为CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)△H=﹣akJ•mol﹣1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.①能说明该反应已达平衡状态的是(填编号).
A.单位时间内每消耗1.2mol H2 , 同时生成0.4mol H2O
B.CO2的体积分数在混合气体中保持不变
C.混合气体的平均相对分子质量不随时间的变化而变化
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②若要使K=1,则改变的条件可以是(填选项).
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加入催化剂.
 24. 有一种用CO2生产甲醇燃料的方法.已知:
24. 有一种用CO2生产甲醇燃料的方法.已知:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(l)△H=﹣akJ•mol﹣1;
CH3OH(g)═CH3OH(l)△H=﹣bkJ•mol﹣1;
2H2(g)+O2(g)═2H2O(l)△H=﹣ckJ•mol﹣1;
则表示CH3OH(l)燃烧热的热化学方程式为 .
25. 在恒容绝热(不与外界交换能量)条件下进行2A(g)+B(g)⇌3C(g)+2D(s)反应,按下表数据投料,反应达到平衡状态,测得体系压强升高.物质
A
B
C
D
起始投料/mol
2
2
3
0
该反应的平衡常数表达式为K= . 升高温度,平衡常数将(填“增大”“减小”或“不变”).
26. 为研究不同条件对反应2NO(g)+Cl2(g)⇌2ClNO(g)△H<0的影响,在恒温下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2 , 10min时反应达到平衡,测得NO的转化率为α1;其他条件保持不变,反应在恒压条件下进行,达到平衡时NO的转化率为α2 , 则α1α2(填“大于”“小于”或“等于”).