山东省泰安市2018年初中学业水平考试化学试题
试卷更新日期:2018-06-25 类型:中考真卷
一、选择题
-
1. “绿水青山就是金山银山”。你认为下列做法与这理念不相符的是( )A、工业废水经处理达标后排放 B、使用一些新型可降解的塑料,减少”白色污染” C、自带水杯出行,不用一次性纸杯 D、将校园散落的塑料袋、树叶集中焚烧,保持整洁的环境2. 下列物质中。属于纯净物的是( )A、空气 B、煤 C、蒸馏水 D、赤铁矿石3. 下列数据为常见水果的pH,其中酸性最强的是( )A、柠檬pH(2~3)
 B、橙子pH(3~4)
B、橙子pH(3~4)  C、西红柿pH(4~5)
C、西红柿pH(4~5)  D、柿子pH(5~6)
D、柿子pH(5~6)  4. 下列物质由离子构成的是( )A、二氧化碳 B、氯化钾 C、铜 D、氧气5. 实验室制取气体选择收集方法时,下列气体性质不需考虑的是( )A、密度 B、可燃性 C、溶解性 D、能否与水反应6. 硅是信息技术的关键材料。从石英砂制取芯片的重要反应是SiO2+2C Si+2CO↑,该反应属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应7. 下列实验基本操作中,正确的是( )A、氧气验满
4. 下列物质由离子构成的是( )A、二氧化碳 B、氯化钾 C、铜 D、氧气5. 实验室制取气体选择收集方法时,下列气体性质不需考虑的是( )A、密度 B、可燃性 C、溶解性 D、能否与水反应6. 硅是信息技术的关键材料。从石英砂制取芯片的重要反应是SiO2+2C Si+2CO↑,该反应属于( )A、化合反应 B、分解反应 C、置换反应 D、复分解反应7. 下列实验基本操作中,正确的是( )A、氧气验满 B、加热液体
B、加热液体  C、滴加液体
C、滴加液体  D、收集二氧化碳
D、收集二氧化碳  8. 下列化学肥料中属于复合肥料的是( )A、硫酸钾[K2SO4] B、尿素[CO(NH2)2] C、硝酸铵(NH4NO3] D、磷酸二氢钾[KH2PO4]9. 下列物品所使用的材料中,属于有机合成材料的是( )A、铝合金炉架
8. 下列化学肥料中属于复合肥料的是( )A、硫酸钾[K2SO4] B、尿素[CO(NH2)2] C、硝酸铵(NH4NO3] D、磷酸二氢钾[KH2PO4]9. 下列物品所使用的材料中,属于有机合成材料的是( )A、铝合金炉架 B、手机塑料外壳
B、手机塑料外壳  C、玻璃杯
C、玻璃杯  D、羊毛围巾
D、羊毛围巾  10. 制造C919大飞机采用的非金属材料氮化硅(Si3N4),其中氮元素的化合价是-3价,则硅元素的化合价是( )A、+1 B、+2 C、+3 D、+411. 从安全的角度考虑,下列做法不合理的是( )A、浓硫酸不慎沾到皮肤上,应立即用大量的水冲洗,再涂上氢氧化钠溶液 B、霉变的大米经洗净、高温蒸煮后也不能食用 C、误食重金属盐,可服用豆浆、牛奶等解毒,并及时就医 D、遇到火灾时,用湿毛巾捂住口鼻,蹲下靠近地面,迅速离开现场12. 物质的性质决定其用途,下列关于物质的用途错误的是( )A、铜——做导线 B、小苏打——治疗胃酸过多 C、碳酸钡——用于钡餐透视 D、干冰——用于人工降雨13. 全球近140个国家将根据签署的《国际防治汞污染公约》,在2020年前禁止生产和出口含汞产品,如电池、荧光灯、化妆品、温度计、血压计等。汞元素部分信息如图所示,下列说法错误的是( )
10. 制造C919大飞机采用的非金属材料氮化硅(Si3N4),其中氮元素的化合价是-3价,则硅元素的化合价是( )A、+1 B、+2 C、+3 D、+411. 从安全的角度考虑,下列做法不合理的是( )A、浓硫酸不慎沾到皮肤上,应立即用大量的水冲洗,再涂上氢氧化钠溶液 B、霉变的大米经洗净、高温蒸煮后也不能食用 C、误食重金属盐,可服用豆浆、牛奶等解毒,并及时就医 D、遇到火灾时,用湿毛巾捂住口鼻,蹲下靠近地面,迅速离开现场12. 物质的性质决定其用途,下列关于物质的用途错误的是( )A、铜——做导线 B、小苏打——治疗胃酸过多 C、碳酸钡——用于钡餐透视 D、干冰——用于人工降雨13. 全球近140个国家将根据签署的《国际防治汞污染公约》,在2020年前禁止生产和出口含汞产品,如电池、荧光灯、化妆品、温度计、血压计等。汞元素部分信息如图所示,下列说法错误的是( )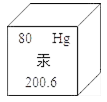 A、汞为非金属元素 B、汞原子的核外电子数是80 C、汞原子的质子数为80 D、汞的相对原子质量为200.614. 下列实验现象,描述错误的是( )A、电解水时正极和负极产生气体的体积比为2:1 B、铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体 C、将一氧化碳通入灼热的氧化铁,红色粉末逐渐变为黑色粉末 D、向硫酸铜溶液中滴加氢氧化钠溶液,产生蓝色沉淀15. 下列化学用语的使用及其表示的意义,正确的是( )A、H2O——一个水分子中含有一个氢分子和一个氧原子 B、4H——4个氢元素 C、Ca+2——一个钙离子带二个单位正电荷 D、2CO2——两个二氧化碳分子16. 如图是五种粒子的结构示意图,下列说法正确的是( )
A、汞为非金属元素 B、汞原子的核外电子数是80 C、汞原子的质子数为80 D、汞的相对原子质量为200.614. 下列实验现象,描述错误的是( )A、电解水时正极和负极产生气体的体积比为2:1 B、铁丝在氧气中剧烈燃烧,火星四射,生成黑色固体 C、将一氧化碳通入灼热的氧化铁,红色粉末逐渐变为黑色粉末 D、向硫酸铜溶液中滴加氢氧化钠溶液,产生蓝色沉淀15. 下列化学用语的使用及其表示的意义,正确的是( )A、H2O——一个水分子中含有一个氢分子和一个氧原子 B、4H——4个氢元素 C、Ca+2——一个钙离子带二个单位正电荷 D、2CO2——两个二氧化碳分子16. 如图是五种粒子的结构示意图,下列说法正确的是( ) A、①②属于同种元素 B、③⑤化学性质相似 C、②③④均表示离子 D、②④形成的化合物是MgCl17. 某同学对所学部分化学知识归纳如下,其中有错误的一组是( )
A、①②属于同种元素 B、③⑤化学性质相似 C、②③④均表示离子 D、②④形成的化合物是MgCl17. 某同学对所学部分化学知识归纳如下,其中有错误的一组是( )A.物质的分离
B.物质的鉴别
淡化海水一蒸馏 海水晒盐一蒸发
氨气、氧气、一氧化碳、二氧化碳——带火星的木条
硝酸铵、氢氧化钠、氯化钠三种固体——水
C.化学与健康
D.化学与生活
缺铁——易引起贫血
缺乏维生素C——会引起坏血病
洗去餐具上的油污——洗洁精
使媒燃烧更旺——把煤做成蜂窝状
A、A B、B C、C D、D18. 甲、乙两种固体物质(均不含结晶水)的溶解度曲线如图所示,下列说法正确的是( )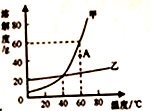 A、甲、乙物质都适用降温结晶法使溶质从溶液中析出 B、60℃时将40g甲物质加入50g水中能得到90g饱和溶液 C、通过降温能使A点甲的不饱和溶液变为饱和溶液 D、分别将甲、乙物质饱和溶液从60℃降至20℃,甲析出晶体较多19. 从海水中制备纯碱和金属镁的流程如下图所示:
A、甲、乙物质都适用降温结晶法使溶质从溶液中析出 B、60℃时将40g甲物质加入50g水中能得到90g饱和溶液 C、通过降温能使A点甲的不饱和溶液变为饱和溶液 D、分别将甲、乙物质饱和溶液从60℃降至20℃,甲析出晶体较多19. 从海水中制备纯碱和金属镁的流程如下图所示:
下列说法错误的是( )
A、流程I依次向粗盐水中加入过量Ca(OH)2溶液、Na2CO3溶液和适量稀盐酸去除杂质 B、流程II吸氨是使溶液呈碱性,有利于吸收二氧化碳 C、上述流程涉及到三种基本反应类型 D、流程IV、V是通过化学方法富集氯化镁20. 向某盐酸和氯化镁的混合溶液中加入某浓度的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液的质量关系如图所示。下列说法错误的是( ) A、a点溶液中滴入紫色石蕊试液变红 B、bc段(不含b点)反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl C、整个变化过程中氯离子数目没有改变 D、d点溶液中含有两种溶质
A、a点溶液中滴入紫色石蕊试液变红 B、bc段(不含b点)反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl C、整个变化过程中氯离子数目没有改变 D、d点溶液中含有两种溶质二、非选择题
-
21. “水循环”、“氧循环”和 “碳循环”是自然界存在的三大重要循环。请结合下图回答问题:
 (1)、从物质变化及分子角度看,三种循环中有一种与另外两种在变化上有本质的区别,这种循环主要是由的运动引起的;(2)、用学科观点分析碳循环和氧循环,其中正确的是___(填字母序号);A、变化观:每个人都在参与碳、氧循环 B、守恒观:碳、氧循环过程中各元素守恒,其化合价不变 C、平衡观:碳、氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定 D、微粒观:绿色植物的作用是使自然界中的氧原子总数增加(3)、自然界中的碳循环主要是通过二氧化碳来实现的。图中消耗二氧化碳的途径有(填数字序号)。近年来,大气中二氧化碳含量增加,导致温室效应,因此人类要积极采取措施维持循环体系中二氧化碳的相对平衡;
(1)、从物质变化及分子角度看,三种循环中有一种与另外两种在变化上有本质的区别,这种循环主要是由的运动引起的;(2)、用学科观点分析碳循环和氧循环,其中正确的是___(填字母序号);A、变化观:每个人都在参与碳、氧循环 B、守恒观:碳、氧循环过程中各元素守恒,其化合价不变 C、平衡观:碳、氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定 D、微粒观:绿色植物的作用是使自然界中的氧原子总数增加(3)、自然界中的碳循环主要是通过二氧化碳来实现的。图中消耗二氧化碳的途径有(填数字序号)。近年来,大气中二氧化碳含量增加,导致温室效应,因此人类要积极采取措施维持循环体系中二氧化碳的相对平衡; (4)、为解决日益加剧的温室效应,有科学家提出”绿色自由”构想:把CO2含量高的气体用氢氧化钠溶液吸收,然后再通过化学反应在分解池内放出二氧化碳进入合成塔,在合成塔内300℃、200kPa和催化剂条件下使之变为甲醇(CH3OH)和水。写出该反应的化学方程式。22. 宏观和微观相联系是化学独特的思维方式。(1)、微观探析化学反应的规律是化学科学的核心任务。根据下列微观示意图回答问题:
(4)、为解决日益加剧的温室效应,有科学家提出”绿色自由”构想:把CO2含量高的气体用氢氧化钠溶液吸收,然后再通过化学反应在分解池内放出二氧化碳进入合成塔,在合成塔内300℃、200kPa和催化剂条件下使之变为甲醇(CH3OH)和水。写出该反应的化学方程式。22. 宏观和微观相联系是化学独特的思维方式。(1)、微观探析化学反应的规律是化学科学的核心任务。根据下列微观示意图回答问题:
①从微粒的角度说明图A反应的实质是;
②图B所示反应中,参加反应的微粒是(写出微粒的符号)。
(2)、化学上有一种能将微观粒子数目与宏观物质质量联系起来的量,叫物质的量,其单位是摩尔。1摩尔任何物质中含有构成它的微粒个数都是6.02×1023个,1摩尔任何物质的质量是以克为单位,数值上都等于该物质的化学式量。例如1摩尔水的各种量关系如下:
①1摩尔水中氢原子数目是个;②1摩尔水中氧元素质量为g。
23. 利用坐标系建立物质间的关系是总结化学知识的一种方法。A-M是初中化学常见的九种物质,下图是根据这九种物质的类别和其中某种元素的化合价构建的它们之间的转化关系(图中”→“表示一种物质转换成另一种物质) ,已知A和水反应放出大量的热。请回答下列问题:
 (1)、A的俗名是;(2)、H、G均可与M溶液反应,分别生成含该金属元素的两种盐溶液。G与M的反应常用于工业除锈,该反应的化学方程式为 ;(3)、D是由三种元素组成的化合物,在B溶液中加入一定量 D溶液,过滤后取滤液,滴入过量M溶液,无明显现象,则滤液中的溶质是(写出所有可能情况,填化学式);(4)、A-H八种物质中能与M溶液反应的物质有种。24. 以下是初中化学一些基本实验,请根据实验内容回答下列问题:(1)、利用下图进行粗盐中难溶性杂质去除和配制一定质量分数氯化钠溶液的实验。
(1)、A的俗名是;(2)、H、G均可与M溶液反应,分别生成含该金属元素的两种盐溶液。G与M的反应常用于工业除锈,该反应的化学方程式为 ;(3)、D是由三种元素组成的化合物,在B溶液中加入一定量 D溶液,过滤后取滤液,滴入过量M溶液,无明显现象,则滤液中的溶质是(写出所有可能情况,填化学式);(4)、A-H八种物质中能与M溶液反应的物质有种。24. 以下是初中化学一些基本实验,请根据实验内容回答下列问题:(1)、利用下图进行粗盐中难溶性杂质去除和配制一定质量分数氯化钠溶液的实验。
①粗盐中难溶性杂质去除的主要操作顺序是(填字母序号);
②配制11%的氯化钠溶液100g。如按下图进行称量和量取,其它操作均规范无误,最终导致配制的氯化钠溶液的溶质质量分数(填“大于”、“小于”或”不能确定”)11%。
 (2)、下图为某小组探究金属化学性质的两组实验。
(2)、下图为某小组探究金属化学性质的两组实验。
①实验I中以“金属表面产生气泡的快慢”为标准来判断锌、铁的活动性强弱,有同学认为不够合理,理由是;
②写出实验II中C试管内反应的化学方程式;
③实验II中要验证Cu、Fe、Ag的金属活动性顺序,至少要做的实验是 (填字母序号)。
25. 某化学兴趣小组的同学,通过咨询老师准备用亚硫酸钠溶液与浓硫酸反应来制备一 定量的SO2(Na2SO3 +H2SO4(浓)=Na2SO4+SO2↑+H2O]。老师给他们提供了一瓶亚硫酸钠溶液并告知该瓶溶液放置时间可能较长,不知是否变质。兴趣小组的同学分成甲、乙两小组对该瓶亚硫酸钠溶液成分进行实验探究。【提出问题】①该瓶溶液中溶质的成分是什么?
②该瓶溶液中亚硫酸钠的质量分数是多少?
【查阅资料】
①Na2SO3有较强还原性,在空气中易被氧气氧化:2 Na2SO3 +O2=2Na2SO4;
②Na2SO3能与酸反应产生SO2气体;
③SO32-、SO42-均能与Ba2+反应产生白色沉淀,BaSO3可溶于稀盐酸。
(1)、【作出猜想】猜想1:没有变质,成分是Na2SO3;
猜想2完全变质,成分是Na2SO4;
你认为还可能有的猜想3:。
(2)、【实验探究I】甲、乙两组分别进行实验探究溶液是否变质:小组
实验操作
现象
结论
甲组
取少量样品于试管中加入过量稀盐酸;
产生气泡
没有变质,还是Na2SO3
乙组
取少量样品于试管中加入氯化钡溶液,再加入足量稀盐酸。
已部分变质
【评价】有同学质疑甲组方案不合理,理由是。
(3)、【实验探究II】甲组设计如下实验测定Na2SO3溶液的溶质质量分数。(注:空气中二氧化碳的影响忽略不计)

①连好装置并检查装置气密性,在锥形瓶中放入126g该样品
②实验前称量C装置的质量;
③关闭活塞K,用注射器推入浓硫酸至不再产生气泡;
④打开活塞K,缓缓鼓入一定量的氮气,关闭活塞K;
⑤再次称量C装置的质量发现比反应前增重6.4g。
由此,计算出该溶液中Na2SO3的质量分数为;
【解释】若没有进行第4步操作,则测得亚硫酸钠溶液的溶质质量分数比实际的(填”偏小”或”偏大”)。
(4)、乙组仍使用第一次实验的原理,进行如下实验测定Na2SO3溶液的溶质质量分数。第一步:称取试样ag;
第二步:在溶液中加入过量氯化钡溶液和足量稀盐酸;
第三步:过滤、洗涤、烘干沉淀;
第四步:称量沉淀的质量为bg;
第五步:计算溶液中Na2SO3的溶质质量分数=(1-142b/233a) ×100%。
试完成下列问题:
①加入氯化钡溶液过量的目的是;
②第三步操作要洗涤沉淀的原因是;
【反思】由此可得出,保存亚硫酸钠时应。
26. 儿童缺锌会引起食欲不振、发育不良等症状。如下图为某补锌口服液说明书的部分信息,图中葡萄糖酸锌化学式已不完整,请根据相关信息回答下列问题: (1)、葡萄糖酸锌的化学式量是455,则葡萄糖酸锌化学式中氢原子右下角的数字为多少;(2)、若儿童1kg体重每日需要0.5mg锌,每天从食物中只能摄入所需锌的一半。体重为20kg的儿童,理论上一天还需服该口服液多少支?27. 厨房中使用的食用碱(主要成分碳酸钠)中往往含有少量的氯化钠,化学兴趣小组的同学通过实验来测定某品牌的食用碱样品中碳酸钠的质量分数。他们实验的过程和数据如下图所示。
(1)、葡萄糖酸锌的化学式量是455,则葡萄糖酸锌化学式中氢原子右下角的数字为多少;(2)、若儿童1kg体重每日需要0.5mg锌,每天从食物中只能摄入所需锌的一半。体重为20kg的儿童,理论上一天还需服该口服液多少支?27. 厨房中使用的食用碱(主要成分碳酸钠)中往往含有少量的氯化钠,化学兴趣小组的同学通过实验来测定某品牌的食用碱样品中碳酸钠的质量分数。他们实验的过程和数据如下图所示。
计算:该食用碱中碳酸钠的质量分数是多少? (计算结果精确至0.1%)