浙教版科学九上 1.5 酸和碱之间发生的反应 同步练习
试卷更新日期:2018-06-23 类型:同步测试
一、单选题
-
1. 在氢氧化钠溶液中加入一定量的稀盐酸后,下列实验能证明两者恰好完全中和的是( )A、滴入适量 FeCl3 溶液,溶液变黄,但无沉淀生成 B、滴入几滴酚酞试液,酚酞试液不变色 C、滴入适量 AgNO3 溶液和稀硝酸,观察到有白色沉淀 D、测得反应后溶液中 Na+与 Cl-的个数比为 1:12. 向一定量的稀盐酸中加入过量 NaOH 溶液,下列图象能正确反映其对应变化关系的是( )
A、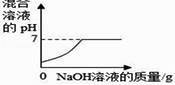 B、
B、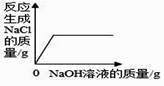 C、
C、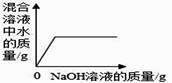 D、
D、 3. 小明同学往氢氧化钠溶液中滴加稀盐酸研究中和反应时,忘记了滴加酸碱指示剂.为了确认滴加的盐酸是否已经过量,从烧杯中取少量反应后的溶液于试管中,用某种试剂进行检验.下表是小明同学设计的实验方案;其中不正确的是( )
3. 小明同学往氢氧化钠溶液中滴加稀盐酸研究中和反应时,忘记了滴加酸碱指示剂.为了确认滴加的盐酸是否已经过量,从烧杯中取少量反应后的溶液于试管中,用某种试剂进行检验.下表是小明同学设计的实验方案;其中不正确的是( )实验方案
使用的试剂
判断的方法
A
铁粉
如果有气泡产生,表明盐酸已经过量
B
pH试纸
如果pH<7,表明盐酸已经过量
C
无色酚酞试剂
如果溶液变成不变色,表明盐酸已经过量
D
紫色石蕊试剂
如果溶液变成红色,表明盐酸已经过量
A、A B、B C、C D、D4. 逻辑推理是化学学习中常用的思维方法。下列推理结果正确的是 ( )A、酸碱中和反应生成盐和水,则生成盐和水的反应一定是中和反应 B、氧化物中都含有氧元素,则含有氧元素的化合物一定是氧化物 C、碱溶液的pH >7,则pH >7的溶液一定是碱的溶液 D、点燃H2和O2的混合气体可能发生爆炸,则H2点燃前须检验纯度5. 下列关于“物质﹣﹣用途﹣﹣性质”的说法不正确的是( )A、汽油﹣﹣去除油污﹣﹣能乳化油污 B、天然气﹣﹣用作燃料﹣﹣具有可燃性 C、液氮﹣﹣用作冷冻麻醉剂﹣﹣能气化吸热 D、氢氧化镁﹣﹣治疗胃酸过多症﹣﹣能与胃液中的盐酸发生中和反应6. 下列图象正确反映对应的变化关系的是( )
①:往食盐溶液中滴加足量的稀硫酸
②:向含有HCl和H2SO4的混合液中滴加足量的Ba(OH)2
③:将足量的MgO、MgCO3固体分别加入到相同质量、质量分数的稀盐酸中
④:在一定温度下,向接近饱和的KNO3溶液中加入足量的KNO3晶体(不含水分子)
A、①② B、②③ C、③④ D、②④7. 酸与碱作用生成盐和水的反应,叫做中和反应,它在工农业生产和日常生活中有着广泛的用途,下列不属于中和反应应用的是( )A、用稀硫酸除铁锈 B、施用熟石灰改良酸性土壤 C、用氢氧化钠溶液洗涤石油产品中残余的硫酸 D、服用含氢氧化铝的药物(如斯达舒)来治疗胃酸过多8. 如图是氢氧化钠溶液与稀盐酸恰好完全反应的微观示意图,由此得出的结论错误的是( )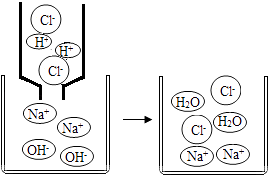 A、向反应结束时的溶液中滴入酚酞溶液,溶液不变色 B、反应前后元素的种类没有变化 C、反应后溶液中存在的粒子只有Na+和Cl﹣ D、该反应的实质是H+和OH﹣ 结合生成水9. 比较归纳是科学学习中的常用方法。若以下的物质转化都由一步反应完成,则( )
A、向反应结束时的溶液中滴入酚酞溶液,溶液不变色 B、反应前后元素的种类没有变化 C、反应后溶液中存在的粒子只有Na+和Cl﹣ D、该反应的实质是H+和OH﹣ 结合生成水9. 比较归纳是科学学习中的常用方法。若以下的物质转化都由一步反应完成,则( )①Mg→MgCl2 ②Mg(OH)2→MgCl2 ③MgCO3→MgCl2。
A、三种转化发生的都是复分解反应 B、三种转化都必须加入盐酸才能进行 C、只有②发生了中和反应 D、三种转化的生成物中都有水10. 完全中和一定量的某盐酸溶液,需要100克8%的KOH溶液,若改用100克8%的NaOH溶液,则反应后溶液的pH为( )A、大于7 B、小于7 C、等于7 D、无法确定二、填空题
-
11. 现有白纸、溶质量分数为(A)10%的NaOH溶液(B)5%H2SO4溶液(C)5%的紫色石蕊试液.试设计《“雨”落叶出红花开》的趣味实验,现在白纸上用玻璃棒蘸取(填序号,下同) 画出花,再蘸画出叶,将白纸挂上墙,用向纸上一喷即可.实验的化学原理是 .12. 生活离不开化学,处处留心皆学问,请用下列物质的序号填空.
a.甲烷 b.熟石灰 c.干冰 d.活性炭
(1)、可用于改良酸性土壤的是;(2)、新农村建设中,许多家庭建了沼气池,沼气的主要成分是;(3)、可用于净水的是;(4)、可用于人工降雨的是 .13. 室温下,将稀盐酸慢慢滴入装有氢氧化钠溶液的烧杯中,利用温度计测出烧杯中溶液的温度,溶液温度随加入盐酸的质量而变化的曲线如图:
(1)、由如图可知,盐酸与氢氧化钠溶液中和反应是 (填“吸热”、“放热”或“无热量变化”)反应.
(2)、在 A 处溶液中加入石蕊,溶液呈色.(3)、C 处溶液的溶质是(填化学式).(4)、B 到 C 的过程中溶液的 pH 逐渐(填“增大”、“减小”或“无变化”).(5)、B 到 C 的过程中降温原因为 .14. 化学源于生活,生活中很多现象蕴含着化学知识,请你填空:(1)、春天小明同学来到了邕江河边,发现河水清澈透明,如果要测定该河水的酸碱度,应选用 (填字母号)A、石蕊试液 B、酚酞试液 C、pH试纸.(2)、医生建议胃酸过多病人须服用抗酸药.下表为两种抗酸药的有效成分及其构成微粒:抗胃酸药
复方氢氧化镁片剂
铝碳酸镁片
有效成分
Mg(OH)2
AlMg(OH)3CO3
构成微粒
Mg2+、OH﹣
Al3+、Mg2+、OH﹣、CO32﹣
由于抗酸药有效成分不同,起抗酸作用(即消耗胃液中盐酸)的微粒也有差异.
①Mg(OH)2起抗酸作用的微粒是(填微粒符号,下同).该药物和盐酸反应叫反应.
②铝碳酸镁与盐酸的反应为:AlMg(OH)3CO3+5HCl=MgCl2+AlCl3+4H2O+CO2↑.铝碳酸镁起抗酸作用的两种微粒是、 .
15. 若采用手持技术(如图1)做“盐酸中和氢氧化钠溶液”的实验.则不需要加入酚酞作为指示剂就很容易判断反应的终点和溶液的酸碱性.图2是实验时采集的溶液pH和溶液温度随所加入溶液体积的变化曲线,请你根据图中曲线判断:图中的横坐标是溶液体积,当该溶液体积是mL时,盐酸中和氢氧化钠溶液恰好反应,此时溶液的pH为 , 温度为 . 16. 根据问题填空:
16. 根据问题填空:
(1)、用熟石灰中和一定量的硫酸时,溶液的pH与加入的熟石灰质量的关系如图所示.熟石灰与硫酸反应的化学方程式为 , 反应的实质 . (2)、当加入熟石灰mg时,溶液中的溶质为 . 若改用n g氢氧化钠与相同质量硫酸反应,所得溶液的pH7.(填“>”、“<”或“=”)(3)、小明对熟石灰深入了解知,长期暴露在空气中会变质,试写出变质的化学方程式 , 因此需保存.17. 在氢氧化钠溶液中加入x溶液并插入温度计,逐滴加入硫酸溶液,观察到红色褪去,温度计示数上升.证明碱与酸能发生反应,且放出热量.(1)、加入的X溶液应该是溶液;(2)、请写出该反应的化学反应方程式;(3)、甲同学提出滴入的硫酸不能用浓硫酸,他的理由是(4)、乙同学提出红色褪去不能说明酸和碱恰好反应完全,为了证明硫酸是否过量,可以取上层清液再加入(填序号),若有现象,说明硫酸过量.
(2)、当加入熟石灰mg时,溶液中的溶质为 . 若改用n g氢氧化钠与相同质量硫酸反应,所得溶液的pH7.(填“>”、“<”或“=”)(3)、小明对熟石灰深入了解知,长期暴露在空气中会变质,试写出变质的化学方程式 , 因此需保存.17. 在氢氧化钠溶液中加入x溶液并插入温度计,逐滴加入硫酸溶液,观察到红色褪去,温度计示数上升.证明碱与酸能发生反应,且放出热量.(1)、加入的X溶液应该是溶液;(2)、请写出该反应的化学反应方程式;(3)、甲同学提出滴入的硫酸不能用浓硫酸,他的理由是(4)、乙同学提出红色褪去不能说明酸和碱恰好反应完全,为了证明硫酸是否过量,可以取上层清液再加入(填序号),若有现象,说明硫酸过量.①铜 ②镁 ③BaCl2溶液 ④KOH溶液.
三、解答题
-
18.
据图填空:
 (1)、图1所示实验中发生的化学反应方程式是:;(2)、图1所示反应恰好完成时的现象是;
(1)、图1所示实验中发生的化学反应方程式是:;(2)、图1所示反应恰好完成时的现象是;小明认为图2、3中的可以代表此时的溶液中所含有的粒子(其中的水分子和极少量的酚酞没有画出,并认为可以用实验证明他的猜想是正确的.
(3)、根据图1反应历程图4、5中能正确反应盐酸和氢氧化钠溶液发生反应过程中溶液的pH的变化曲线是: .(4)、用溶质的质量分数为36.5%的盐酸40g与足量氢氧化钠溶液恰好完全反应,需要溶质的质量分数为20%的氢氧化钠溶液 g.19. 某石化厂有一种石油产品含有质量分数为4.9%的残余硫酸,过去他们都是用NaOH溶液来清洗这些硫酸。NaOH和Ca(OH)2的市场价格如下表:名称
Ca(OH)2
NaOH
价格(元/千克)
6.00
24.00
(1)、若要清洗50千克这种石油产品,需要多少千克NaOH?(2)、石化厂进行了技术改造,采用Ca(OH)2中和这些残余硫酸。每处理50千克这种产品,可以节约多少经费?20. 将m1g 7.3% HCl溶液和m2g未知浓度的NaOH溶液混合均匀,测量并记录溶液温度,实验结果如右图所示(实验中始终保持m1+m2=50g)。 (1)、做该实验时环境温度为℃左右。(2)、实验过程中溶液温度升高的原因是。(3)、图中A点所得溶液中的两种溶质是。(4)、通过计算确定NaOH溶液的溶质质量分数为多少?
(1)、做该实验时环境温度为℃左右。(2)、实验过程中溶液温度升高的原因是。(3)、图中A点所得溶液中的两种溶质是。(4)、通过计算确定NaOH溶液的溶质质量分数为多少?四、实验探究题
-
21.
某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂.因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究.
 (1)、Ⅰ、写出该反应的化学方程式: .
(1)、Ⅰ、写出该反应的化学方程式: .Ⅱ、探究烧杯内溶液中溶质的成分.
【提出问题】:该烧杯内溶液中的溶质是什么?
【猜想】:猜想一:可能是CaCl2和Ca(OH)2;猜想二:可能只有CaCl2;猜想三: .
【查阅资料】:氯化钙溶液呈中性.
(2)、【进行试验】:实验步骤:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡.
实验现象:结论:猜想一不正确.
实验步骤:实验步骤取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量.
实验现象: 结论:猜想二不正确,猜想三正确.
(3)、【反思与拓展】:(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑 .
(2)根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验? (填序号)
a.pH试纸 b.铜 c.紫色石蕊溶液 d.硝酸银溶液
(3)烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是(写一条).要处理烧杯内溶液,使其溶质只含有CaCl2 , 应向烧杯中加入过量的 .
22.透过现象看本质是科学课堂的精髓,借助科学实验现象如溶液颜色变化、沉淀的生产或沉淀、气体逸出等,可以帮助我们确认化学反应是否发生.
 (1)、稀盐酸与氢氧化铜反应,可以直接观察现象来确认.如图甲,实验中的现象出现,证明稀盐酸与氢氧化铜能发生化学反应;(2)、稀盐酸与稀氢氧化钠溶液反应没有明显现象,可借助酸碱指示剂使反应现象外显可见.如图乙,通过观察现象,证明氢氧化钠溶液和稀盐酸发生化学反向.本实验选用无色酚酞试液比选用紫色石蕊试液更合适的原因是23. 将0.4%的氢氧化钠溶液滴加到2mL0.4%的盐酸中,测得混合液的pH变化曲线如图。某学习小组对加入0~VmL氢氧化钠过程中,所得混合液pH增大原因进行了如下探究:
(1)、稀盐酸与氢氧化铜反应,可以直接观察现象来确认.如图甲,实验中的现象出现,证明稀盐酸与氢氧化铜能发生化学反应;(2)、稀盐酸与稀氢氧化钠溶液反应没有明显现象,可借助酸碱指示剂使反应现象外显可见.如图乙,通过观察现象,证明氢氧化钠溶液和稀盐酸发生化学反向.本实验选用无色酚酞试液比选用紫色石蕊试液更合适的原因是23. 将0.4%的氢氧化钠溶液滴加到2mL0.4%的盐酸中,测得混合液的pH变化曲线如图。某学习小组对加入0~VmL氢氧化钠过程中,所得混合液pH增大原因进行了如下探究: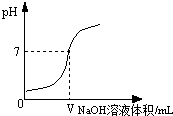 (1)、【猜想假设】
(1)、【猜想假设】猜想Ⅰ:pH增大是因为;
猜想Ⅱ:pH增大是因为发生了反应,写出反应方程式;
(2)、【实验探究】为验证猜想Ⅱ,请你帮助该小组完成下列实验.(可供选择的实验用品有:pH计、0.4%的氢氧化钠溶液、0.4%的盐酸、水)
①向2mL0.4%的盐酸中加入VmL0.4%的氢氧化钠溶液,用pH计测得混合液的pH=7;
②向2mL0.4%的盐酸中加入VmL , 用pH计测得混合液的pH7(填“>”、“=”或“<”);综合①和②证明猜想Ⅱ成立。
24. 做完氢氧化钠与稀硫酸中和反应的实验后,兴趣小组的同学对反应后溶液中的溶质成分产生了兴趣,请你与他们一起进行以下探究.【提出问题】溶液中的溶质是什么物质?
(1)、【作出猜想】Ⅰ、甲同学认为溶液中的溶质只有Na2SO4一种物质.
Ⅱ、乙同学认为溶液中的溶质是Na2SO4和两种物质.
Ⅲ、丙同学认为溶液中的溶质是Na2SO4和NaOH两种物质.
(2)、【查阅资料】①Na2SO4溶液显中性.
②Al与强碱NaOH溶液反应生成偏铝酸钠(NaAlO2)和可燃性气体.
【实验验证】
实验操作
实验现象
实验结论
乙同学
实验
取中和反应后的溶液少许于试管中,将表面反复打磨后的铝片放入试管的溶液中
铝片逐渐溶解,并有大量气泡冒出,收集气体点燃,火焰呈淡蓝色
猜想Ⅱ成立
丙同学
实验
取中和反应后的溶液少许于试管中,向试管中滴加几滴无色酚酞试液
溶液变红色
猜想成立
(3)、【总结反思】丁同学根据乙、丙两位同学的实验现象,首先肯定猜想Ⅰ不成立.经过进一步分析,丁同学认为乙同学实验结论不一定成立,他的理由是 . 兴趣小组的同学经过充分讨论,一致认为猜想Ⅲ成立.25.在实验中无明显现象的化学反应可通过滴加其它试剂的方法,使之产生明显现象以证明反应确实发生.如以下甲、乙两个实验:
 (1)、当观察到实验甲中出现时(填实验现象),说明NaOH与HCl恰好完全反应.(2)、乙和丙中哪个实验与甲类似,也是通过反应前后溶液颜色的改变来证明反应发生的? .(3)、证明实验丙中NaOH与CO2发生了反应,除滴加酸,还可滴加试剂(化学式) .26. 学习酸碱反应时,很多同学对其产生探究兴趣.(1)、甲同学将固体氢氧化钠放入装有稀硫酸的试管中并振荡,试管壁发烫,于是他得出酸碱反应是放热反应的结论.
(1)、当观察到实验甲中出现时(填实验现象),说明NaOH与HCl恰好完全反应.(2)、乙和丙中哪个实验与甲类似,也是通过反应前后溶液颜色的改变来证明反应发生的? .(3)、证明实验丙中NaOH与CO2发生了反应,除滴加酸,还可滴加试剂(化学式) .26. 学习酸碱反应时,很多同学对其产生探究兴趣.(1)、甲同学将固体氢氧化钠放入装有稀硫酸的试管中并振荡,试管壁发烫,于是他得出酸碱反应是放热反应的结论.乙同学认为甲同学推理不合理,理由是 .
(2)、乙同学为了验证甲同学的结论,将实验加以改进:将稀硫酸慢慢滴入装有氢氧化钠溶液的烧杯中,用温度计测出氢氧化钠溶液温度随加入稀硫酸质量的变化情况如图所示: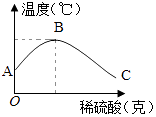
①由图知,稀硫酸与氢氧化钠溶液发生的反应是(填“放热”或“吸热”)反应,B点表示的含义是 .
②从A到B过程中,烧杯中溶液pH逐渐 .
③B到C的过程中,烧杯内溶液中含有的阳离子有(填离子符号).
(3)、丙同学将稀硫酸滴入氢氧化钠溶液中,有气泡产生,他认为氢氧化钠溶液已变质.请你分析变质的原因:(用化学方程式表示).(4)、丁同学认为氢氧化钠溶液与稀硫酸混合没有明显现象,于是他想借助下列溶液来验证反应是否真的发生,你觉得不可行的是 .A、无色酚酞试液 B、FeCl3 C、BaCl2 D、KNO3 .