重庆市2017-2018学年高考理综-化学三模考试试卷
试卷更新日期:2018-06-13 类型:高考模拟
一、单选题
-
1. 化学与社会、生活、科技有着密切的联系,下列说法正确的是( )A、氯气和明矾都能用于自来水的杀菌消毒 B、蚕丝和棉花的组成元素相同,结构不同,因而性质不同 C、利用高纯硅制造的太阳能电池板可将光能直接转化为电能 D、用作舰载机降落拦阻索的特种钢缆,属于无机非金属材料2. 一定条件下,一种反应物过量,另一种反应物仍不能完全反应的是( )A、过量的氧气与二氧化硫 B、过量的浓盐酸与二氧化锰 C、过量的铜与硝酸 D、过量的锌与18mol/L硫酸3. 在日本,金刚烷胺一直作为帕金森病的治疗药,并于1998年被批准用于流感病毒A型感染性疾病的治疗,金刚烷胺的合成路线如图所示。下列说法错误的是( )
 A、金刚烷胶的分子式是C10H17N B、金刚烷胺的一溴代物有四种 C、该路线中的反应都属于取代反应 D、W的同分异构体中一定含有苯环4. 短周期主族元素a、b、c、d原子序数依次增大,a、d同主族,b的原子半径是所有短周期十族元素中最大的,c是地壳中含量最多的金属元素,四种元素原子的最外层电子数总和为16。下列说法正确的是( )A、b的氢化物在常温下为气态 B、最简单氢化物的热稳定性:a>d C、d的氧化物所对应的水化物是强酸 D、原子半径:a<c<d5. 普通锌锰电池筒内无机物主要成分为MnO2、NH4Cl、ZnCl2等。某研究小组探究废于电池内的黑色固体并回收利用时,进行如图所示实验。下列有关实验的叙述正确的是( )
A、金刚烷胶的分子式是C10H17N B、金刚烷胺的一溴代物有四种 C、该路线中的反应都属于取代反应 D、W的同分异构体中一定含有苯环4. 短周期主族元素a、b、c、d原子序数依次增大,a、d同主族,b的原子半径是所有短周期十族元素中最大的,c是地壳中含量最多的金属元素,四种元素原子的最外层电子数总和为16。下列说法正确的是( )A、b的氢化物在常温下为气态 B、最简单氢化物的热稳定性:a>d C、d的氧化物所对应的水化物是强酸 D、原子半径:a<c<d5. 普通锌锰电池筒内无机物主要成分为MnO2、NH4Cl、ZnCl2等。某研究小组探究废于电池内的黑色固体并回收利用时,进行如图所示实验。下列有关实验的叙述正确的是( ) A、操作①中玻璃棒的作用是转移固体 B、操作②为过滤,得到的滤液显碱性 C、操作③中盛放药品的仪器是坩埚 D、操作④的目的是除去滤渣中的杂质6. 《Nature》期刊曾报道一例CH3OH-O2原电池,其工作示意图如下。下列说法错误的是( )
A、操作①中玻璃棒的作用是转移固体 B、操作②为过滤,得到的滤液显碱性 C、操作③中盛放药品的仪器是坩埚 D、操作④的目的是除去滤渣中的杂质6. 《Nature》期刊曾报道一例CH3OH-O2原电池,其工作示意图如下。下列说法错误的是( ) A、电极A是负极,发生氧化反应 B、电解质溶液中H+由A极流向B极 C、电极B的电极反应为:O2+2e-+H+=HO2- D、外电路中通过6mol电子,生成CO2的体积为22.4L7. 25℃时,向20mL0.1mol/LHAuCl4溶液中滴加0.1mol/LNaOH溶液,滴定曲线如图1,含氯微粒的物质的量分数(δ)随pH变化关系如图2,则下列说法错误的是( )
A、电极A是负极,发生氧化反应 B、电解质溶液中H+由A极流向B极 C、电极B的电极反应为:O2+2e-+H+=HO2- D、外电路中通过6mol电子,生成CO2的体积为22.4L7. 25℃时,向20mL0.1mol/LHAuCl4溶液中滴加0.1mol/LNaOH溶液,滴定曲线如图1,含氯微粒的物质的量分数(δ)随pH变化关系如图2,则下列说法错误的是( )
 A、在c点溶液中:c(Na+)=c(AuCl4-) B、a点对应溶液pH约为5 C、25℃时,HAuCl4的电离常数为1×10-3 D、d点时,溶液中离子浓度大小关系为:c(Na+)>c(AuCl4-)>c(OH-)>c(H+)
A、在c点溶液中:c(Na+)=c(AuCl4-) B、a点对应溶液pH约为5 C、25℃时,HAuCl4的电离常数为1×10-3 D、d点时,溶液中离子浓度大小关系为:c(Na+)>c(AuCl4-)>c(OH-)>c(H+)二、综合题
-
8. 硝酸锶可用于制造烟火及信号弹等。工业级硝酸锶[含Ca(NO3)2、Ba(NO3)2等杂质] 的提纯流程如下。(已知: 硝酸锶、硝酸钡不溶于浓硝酸)
 (1)、要加快“酸浸”速率所采取的措施是(写一条即可)。(2)、操作1的名称是 , 洗涤所用的洗涤剂是 .(3)、“滤液2”中过量的H2CrO4被N2H4还原为Cr3+ , 同时放出无污染的气体,写出发生反应的离子方程式;氧化产物与还原产物的物质的量之比为 。(4)、已知Cr(OH)3不溶于水,还原后调节pH=8 的目的是 。(5)、为了测定“残渣2”中Cr元素的质量分数,进行以下实验。(已知: I2+2S2O32-=2I-+S4O62-)
(1)、要加快“酸浸”速率所采取的措施是(写一条即可)。(2)、操作1的名称是 , 洗涤所用的洗涤剂是 .(3)、“滤液2”中过量的H2CrO4被N2H4还原为Cr3+ , 同时放出无污染的气体,写出发生反应的离子方程式;氧化产物与还原产物的物质的量之比为 。(4)、已知Cr(OH)3不溶于水,还原后调节pH=8 的目的是 。(5)、为了测定“残渣2”中Cr元素的质量分数,进行以下实验。(已知: I2+2S2O32-=2I-+S4O62-)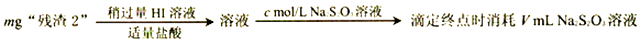
①“残渣2”中Cr元素的质量分数为(用代数式表示)。
②若加入的HI溶液过量太多,测定结果会是(填“偏高”、“偏低”或“无影响”),其原因是。
9. ClO2是一种优良的消毒剂,其溶解度约是Cl2的5倍,但温度过高、浓度过大时均易发生分解,因此常将其制成固体,以便运输和贮存。制备KClO2固体的实验裝置如图所示,其中A装置制备ClO2 , B装置制备KClO2。请回答下列问题: (1)、仪器a的名称是。(2)、滴液漏斗与普通分液漏斗相比,其优点是。(3)、加入的硫酸需要用冰盐水冷却的原因是。(4)、实验过程中通入空气的目的是 , 空气流速过快或过慢,均降低KClO2产率,试解释其原因 。(5)、用图示装置制备的KClO2中含有较多杂质,其原因是。(6)、A中制备ClO2的化学方程式为 。(7)、有人认为用图示装置吸收ClO2易引起倒吸,但经过多次实验均未发现有倒吸现象,其原因是。10. 二氧化硫和硫化氢都是有毒物质,但它们在工业上都有着重要的用途。请回答下列有关问题:(1)、燃煤脱疏是科研工作者研究的重要课题之一,已知有两种脱硫方法,一是活性炭作化氧化法脱流;二是CO还原法脱硫。
(1)、仪器a的名称是。(2)、滴液漏斗与普通分液漏斗相比,其优点是。(3)、加入的硫酸需要用冰盐水冷却的原因是。(4)、实验过程中通入空气的目的是 , 空气流速过快或过慢,均降低KClO2产率,试解释其原因 。(5)、用图示装置制备的KClO2中含有较多杂质,其原因是。(6)、A中制备ClO2的化学方程式为 。(7)、有人认为用图示装置吸收ClO2易引起倒吸,但经过多次实验均未发现有倒吸现象,其原因是。10. 二氧化硫和硫化氢都是有毒物质,但它们在工业上都有着重要的用途。请回答下列有关问题:(1)、燃煤脱疏是科研工作者研究的重要课题之一,已知有两种脱硫方法,一是活性炭作化氧化法脱流;二是CO还原法脱硫。①活性炭在反应过程中作为催化剂,改变了(填选项字母)。
a. 反应限度 b. 反应速率 c. 反应活化能 d. 反应焓变 e.反应路径
②CO还原法的原理是: 2CO(g) +SO2(g) S(g) +2CO2(g),△H。
已知:S(g) +O2(g) =SO2(g),△H1= -574.0kJ/mol,CO的燃烧热为283. 0kJ/mol,则△H=。
③在两个容积为10L的恒容绝热密闭容器中发生反应:
2CO(g) +SO2(g) S(g) +2CO2(g),各起始反应物的物质的量如右表所示,起始温度均为T℃。两容器中平衡常数K甲K乙(填“>”“=”或“<”),理由是。
 (2)、H2S受热发生分解反应: 2H2S(g)= 2H2(g) +S2(g),在密闭容器中,充入0.20mol H2S(g),压强为p时,控制不同的温度进行实验,H2S的平衡转化率如图所示。
(2)、H2S受热发生分解反应: 2H2S(g)= 2H2(g) +S2(g),在密闭容器中,充入0.20mol H2S(g),压强为p时,控制不同的温度进行实验,H2S的平衡转化率如图所示。
①出强为p,温度为T6℃时,反应经tmin达到平衡,则平均反应速率v(S2)=mol/min.
②若压强p=aMPa,温度为T4℃时, 该反应的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
(3)、H2S废气可用足量烧碱溶液吸收,将吸收后的溶液加入由惰性电极组成的电解池中进行电解,阳极区可生成Sx2-。请写出生成Sx2-的电极反应式。11. 磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。磷的化合物在药物生产和农药制造等方面用途非常广泛。请回答下列有关问题:(1)、画出基态P 原子的核外电子排布图。(2)、 NH3比PH3 易液化的原因是。(3)、 P4S3可用于制造火柴,其结构如图1所示。
①P4S3中硫原子的杂化轨道类型为。
②电负性: 磷硫(填“>”或“<”);第一电离能磷大于硫的原因是。
(4)、NH4BF4是合成氮化硼纳米管的原料之一,1mol NH4BF4中含有mol 配位键。(5)、NF3的键角小于NH3的键角,其原因是。(6)、 磷化硼是一种超硬耐磨涂层材料,其晶胞结构如图2 所示。原子坐标参数表示晶胞内部各原子的相对位置,图中a 点和c 点的原子坐标参数依次为(0,0,0)、(1, , ),则b点的原子坐标参数为;已知该晶胞中距离最近的两个磷原子的核间距离为Lpm,则该晶体密度为g.cm-3(阿伏加德罗常数用NA表示,列出计算式即可)。 12. 以有机物X为原料合成聚酯类高分子化合物H的路线如下:
12. 以有机物X为原料合成聚酯类高分子化合物H的路线如下:
已知:

回答下列问题:
(1)、X中宫能团的名称为 , Y→Z的反应类型为。(2)、H的结构简式是 。(3)、W与NaOH水溶液反应的化学方程式为 。(4)、M在一定条件下还可以合成含有六元环状结构的G,其反应方程式为 。(5)、满足下列条件的Z的同分异构体有种(不考虑立体异构)。①含有1个六元碳环,且环上相邻4个碳原子上各连有一个取代基
②1mol该物质与新制的Cu(OH)2悬浊液反应产生2mol砖红色沉淀
(6)、参照题中合成路线图,设计以 为原料(其它无机试剂任选)制备化合物
为原料(其它无机试剂任选)制备化合物  的合成路线如下:
的合成路线如下: 请把路线图中“……”补充完整。
请把路线图中“……”补充完整。