天津市红桥区2017-2018学年高考理综-化学一模考试试卷
试卷更新日期:2018-06-13 类型:高考模拟
一、单选题
-
1. 下列说法错误的是( )A、金属铝制品具有较强的抗腐蚀能力,说明铝的金属活动性较差 B、洁厕灵(主要成分为盐酸)与84消毒液(主要成分为NaClO)混合使用易中毒 C、锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用酸溶解去除 D、利用乙醇的还原性以及Cr3+、Cr2O72-的颜色差异可以检验司机是否酒后驾车2. X、Y、Z、W、R为短周期主族元素,原子序数依次增加,X与W、Y与R分别位于同主族。Z在短周期元系中金属性最强,W元素原子的次外层电子数为最外层电子数的2倍,R的原子序数是Y的2倍。下列有关叙述错误的是( )A、五种元素的原子半径最大的为Z原子 B、Z与Y形成的化合物所含化学键类型完全相同 C、W单质是人类将太阳能转变为电能的常用材料 D、Z与R形成的化合物溶于水对水的电离有促进作用3. 二羟甲戊酸是生物合成青蒿素的原料之一,下列关于二羟甲戊酸的说法正确的是( )
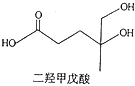 A、与乙醇发生酯化反应生成产物的分子式为C8H18O4 B、能发生加成反应,不能发生取代反应 C、在铜的催化下与氧气反应的产物可以发生银镜反应 D、标准状况下1mol该有机物可以与足量金属钠反应产生22.4LH24. 下列实验的现象所得到的结论正确的是( )
A、与乙醇发生酯化反应生成产物的分子式为C8H18O4 B、能发生加成反应,不能发生取代反应 C、在铜的催化下与氧气反应的产物可以发生银镜反应 D、标准状况下1mol该有机物可以与足量金属钠反应产生22.4LH24. 下列实验的现象所得到的结论正确的是( )选项
实验操作
现象
结论
A
向溶有SO2的BaCl2溶液中通入气体X
产生白色沉淀
X一定是Cl2
B
向NaClO和NaOH的混合溶液中加入H2O2浓溶液
产生大量气泡
碱性条件下,H2O2被ClO-氧化成O2
C
等体积pH=3的HA和HB两种酸溶液分别于足量的锌反应
HA放出的H2多
酸性:HA﹥HB
D
将铜片和铁片用导线连接插入浓硝酸中
铁片表面有气泡产生
金属活动性:Cu﹥Fe
A、A B、B C、C D、D5. CO2是重要的温室气体,对地球温室效应的“贡献”最大,如何利用CO2是摆在科技工作者面前的重要课题。如图所示电解装置可将CO2 转化为乙烯,该装置的电解质溶液为强酸性水溶液,电极材料为惰性电极。
下列有关说法正确的是( )
A、a为电池的正极 B、电解过程中H+移向阳极 C、反应前后溶液的pH保持不变 D、阴极反应式:2CO2+12H++12e-=C2H4+4H2O6. 常温下,取一定量的PbI2固体配成饱和溶液,t时刻改变某一条件,离子浓度变化如图所示。下列有关说法正确的是( ) A、常温下,PbI的Ksp为2×10-6 B、温度不变,向PbI饱和溶液中加入少量硝酸铅浓溶液,平衡向左移动,Pb2+的浓度减小 C、温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大 D、常温下,Ksp(PbS)=8×10-28 , 向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq) PbS(s)+2I-(aq)的化学平衡常数为5×1018
A、常温下,PbI的Ksp为2×10-6 B、温度不变,向PbI饱和溶液中加入少量硝酸铅浓溶液,平衡向左移动,Pb2+的浓度减小 C、温度不变,t时刻改变的条件可能是向溶液中加入了KI固体,PbI2的Ksp增大 D、常温下,Ksp(PbS)=8×10-28 , 向PbI2的悬浊液中加入Na2S溶液,反应PbI2(s)+S2-(aq) PbS(s)+2I-(aq)的化学平衡常数为5×1018二、综合题
-
7. I. “铝热反应”的化学方程式为2Al+Fe2O3 Al2O3+2Fe。某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”。
查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质
Al
Al2O3
Fe
Fe2O3
熔点/℃
660
2 054
1 535
1 462
沸点/℃
2 467
2 980
2 750
——
(1)、该同学推测,铝热反应所得到的熔融物应是铁铝合金。这种推测有一定的道理,理由是。(2)、设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是 , 当观察到时,说明熔融物中含有金属铝。(3)、实验室溶解该熔融物,最好选用下列试剂中的____(填字母)。A、浓硫酸 B、稀硫酸 C、稀硝酸 D、氢氧化钠溶液(4)、II. 已知固体Na2SO3受热易分解。实验流程和结果如下:
气体Y是一种纯净物,在标准状况下的密度为1.518 g·L-1 , 请回答:
气体Y分子的电子式 , 白色沉淀的化学式。
(5)、该流程中Na2SO3受热分解的化学方程式。(6)、另取固体X试样和Na2SO3混合,加水溶解后与稀盐酸反应,有淡黄色沉淀产生,写出产生淡黄色沉淀的离子方程式 (不考虑空气的影响)。8. 化合物H是一种抗病毒药物,在实验室中利用芳香烃A制备H的流程如下图所示(部分反应条件已略去):
已知:①有机物B苯环上只有两种不同环境的氢原子;
②两个羟基连在同一碳上不稳定,易脱水形成羰基或醛基;
③
 ;
;④
 。(1)、有机物B的名称为。(2)、由D生成E的反应类型为 , E中官能团的名称为。(3)、由G生成H所需的“一定条件”为。(4)、写出B与NaOH溶液在高温高压下反应的化学方程式:。(5)、F酸化后可得K,X是K的同分异构体,X能发生银镜反应,且其核磁共振氢谱显示有3种不同化学环境的氢,峰面积比为1:1:1,写出2种符合条件的X的结构简式:。(6)、设计由
。(1)、有机物B的名称为。(2)、由D生成E的反应类型为 , E中官能团的名称为。(3)、由G生成H所需的“一定条件”为。(4)、写出B与NaOH溶液在高温高压下反应的化学方程式:。(5)、F酸化后可得K,X是K的同分异构体,X能发生银镜反应,且其核磁共振氢谱显示有3种不同化学环境的氢,峰面积比为1:1:1,写出2种符合条件的X的结构简式:。(6)、设计由 和丙醛合成
和丙醛合成  的流程图: (其他试剂任选)。 9. 近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:
的流程图: (其他试剂任选)。 9. 近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如下图所示:
回答下列问题:
(1)、进入分解池中主要物质是;在合成塔中,若有4.4kgCO2与足量H2反应,生成气态的H2O和CH3OH,可放出5370kJ的热量,写出该反应的热化学方程式:。(2)、该工艺在哪些方面体现了“绿色自由”构想中的“绿色”:①;②。(3)、一定条件下,往2L恒容密闭容器中充入1.0molCO2和3.0 mol H2 , 在不同催化剂作用下,相同时间内CO2的转化率随温度变化如下图所示:
①催化剂效果最佳的是(填“催化剂I”.“催化剂Ⅱ”,“催化剂Ⅲ”)。b点v(正)v(逆)(填“>”,“<”,“=”)。
②此反应在a点时已达平衡状态,a点的转化率比c点高的原因是。c点时该反应的平衡常数K=。
(4)、科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时的总反应方程式为。 (5)、已知25℃时H2CO3的电离平衡常数为:Kal=4.4×10-7、Ka2=4.7×10-ll , 则反应:HCO3- +H2O H2CO3+ OH-的平衡常数K=。
(5)、已知25℃时H2CO3的电离平衡常数为:Kal=4.4×10-7、Ka2=4.7×10-ll , 则反应:HCO3- +H2O H2CO3+ OH-的平衡常数K=。三、实验题
-
10. 碲被誉为“现代工业、国防与尖端技术的维生素”,它在地壳中平均的丰度值很低,铜阳极泥中碲的回收越来越引起人们的重视。某电解精炼铜的阳极泥经预处理后主要含有TeO2和少量Ag、Au,以此预处理阳极泥为原料制备单质碲的一种工艺流程如下:

已知TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱分别生成Te4+和TeO32-。回答下列问题:
(1)、阳极泥预处理时发生反应: Cu2Te+O2→CuO+TeO2 , Cu2Te中Te的化合价为 , 该反应中氧化剂与还原剂的物质的量之比为。(2)、“过滤I”所得滤液中,阴离子主要有 , 要从滤渣1中分离出Au,可以向滤渣中加入的试剂是。(3)、步骤②控制溶液的pH为4.5~5.0,反应的化学方程式为 , 防止酸度局部过大的操作是。(4)、步骤④发生反应的离子方程式是。(5)、高纯碲的制备采用电解精炼法。将上述流程得到的粗碲溶于NaOH溶液配成电解液,用适当的电极进行电解,阳极产生的气体是 , 阴极上的电极反应式为。