天津市河西区2017-2018学年高考理综-化学三模考试试卷
试卷更新日期:2018-06-13 类型:高考模拟
一、单选题
-
1. 为延长舰船服役寿命可采用的电化学防腐的方法有①舰体与直流电源相连②舰体上镶嵌某种金属块。下列有关说法正确的是( )A、方法①中舰体应连电源的正极 B、方法②中镶嵌金属块可以是锌 C、方法①为牺牲阳极的阴极保护法 D、方法②为外加电流的阴极保护法2. 元素R、X、T、Q在元素周期表中的相对位置如下表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断错误的是( )
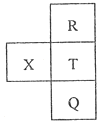 A、非金属性:X<R B、简单离子半径:X2-<Q- C、R与Q的原子序数相差16 D、气态氢化物的稳定性:HT<HR3. 结合下表已知信息,判断下列相关叙述正确的是( )
A、非金属性:X<R B、简单离子半径:X2-<Q- C、R与Q的原子序数相差16 D、气态氢化物的稳定性:HT<HR3. 结合下表已知信息,判断下列相关叙述正确的是( )物质及其编号
分子式
沸点/℃
水溶性
①
甘油
C3H8O3
259
②
1.2-丙二醉
C3H8O2
188
与水以任意比混溶
③
乙醇
C2H6O
197.3
④
丙烷
C3H8
-42.1
难溶于水
A、①、②、③属于一元饱和醇 B、可推测出乙二醇的沸点应低于乙醇的沸点 C、用蒸馏法可将②与③从其混合液中分离出来 D、醇分子之间、醇分子与水分子之间均能形成氢键4. 下列各组离子能大量共存,且当加入试剂后反应的离子方程式书写正确的是( )选项
离子组
加入试剂
发生反应的离子方程式
A
Fe3+、I-、Cl-
NaOH溶液
Fe3+ + 3OH- =Fe(OH)3↓
B
K+、ClO-、SO42-
盐酸
H++ClO- =HClO
C
K+、OH-、Cl-
过量SO2
SO2+ OH-=HSO3-
D
H+、Fe2+、 SO42-
Ba(NO3)2溶液
SO42-+ Ba2+ =BaSO4↓
A、A B、B C、C D、D5. 用下图装置进行①中实验,对应②中现象正确,且能达成相应实验目的的是( )
选项
①中实验
②中现象
实验目的
A
将浸透石蜡油的石棉加热
Br2的CCl4溶液褪色
石蜡裂解产物中含有烯烃
B
加热NH4Cl固体
酚酞溶液变红
制备氨气并检验氨气性质
C
加热NaHCO3与Na2CO3混合粉末
澄清石灰水变浑浊
验证NaHCO3具有热不稳定性
D
加热铁粉及湿棉花
肥皂水中有气泡冒出
Fe与H2O发生了置换反应
A、A B、B C、C D、D6. 已知液氨的性质与水相似。T℃时,NH3+NH3 NH4++NH2- , NH4+的平衡浓度为1×10-15mol/L,则下列说法中正确的是( )A、在此温度下液氨的离子积为1×10-17 B、在液氨中放入金属钠,可生成NaNH2 C、恒温下,在液氨中加入NH4Cl,可使液氨的离子积减小 D、降温,可使液氨电离平衡逆向移动,且c(NH4+)<c(NH2-)二、实验题
-
7. Al、Mg及其化合物在生产、生活中有着广泛的应用,请按要求回答下列问题。
I. 用废铝渣制备Al(OH)3的流程如下图所示,假设反应①杂质不反应。
 (1)、Al在元素周期表中的位置为 , 试剂X的名称 。(2)、溶液A显酸性的原因可能是(可用离子方程式表示) a.盐酸过量;
(1)、Al在元素周期表中的位置为 , 试剂X的名称 。(2)、溶液A显酸性的原因可能是(可用离子方程式表示) a.盐酸过量;B. 。
(3)、II.用镁硅酸盐矿石制备高纯度Mg(OH)2的流程如下图所示:
已知:①溶液M中除含Mg2+、SO42-外,还含少量Fe3+、 Al3+、Fe2+等离子;
②Mg2+与氨水的反应为吸热反应。
向溶液M中先加入的试剂是;产生的沉淀有。H2O2参与反应的离子方程式是。
(4)、溶液N中Mg2+的装化率随温度T的变化情况如图所示。T1之后,Mg , 2+的转化率减小的原因是。
三、推断题
-
8. 有机物N是制备某药品的中间体,其合成路线如下(部分产物和条件已略):

已知: RCN RCOOH RCOCl RCOOR'
请按要求回答下列问题:
(1)、已知A标准状况下的密度为1.25g/L,则A的结构简式为;其分子共平面的原子数目为。(2)、B的官能团名称为。 反应①的反应类型为。F的名称为 。(3)、P是比A相对分子质量大28的同系物,P的所有可能的结构(含p)数目为。写出P的属于环烃的同分异构体的结构简式: 。(4)、写出反应②的化学方程式: 。(5)、已知: 。参照上述流程,设计以G为原料制备K的合成路线(无机试剂任选):。 9. 利用酸解法制钛白粉产生的废液生产铁红(Fe2O3) 和补血剂乳酸亚铁的生产工业流程如下图所示:
。参照上述流程,设计以G为原料制备K的合成路线(无机试剂任选):。 9. 利用酸解法制钛白粉产生的废液生产铁红(Fe2O3) 和补血剂乳酸亚铁的生产工业流程如下图所示:
已知; TiOSO4在大量水中加热条件下可完全水解成为TiO2·xH2O沉淀。
请按要求回答下列问题:
(1)、步骤①加入适量铁屑的目的是。TiOSO4完全水解的化学方程式为。(2)、步骤②的系列操作中,需要控制、条件下,再进行蒸发浓缩、冷却结晶,过滤、洗涤。其中洗涤液选用稀硫酸替代水的优点有。(3)、写出步骤③的化学方程式: 。(4)、某兴趣小组学生以铁屑、稀硫酸、NH4HCO3 溶液为原料,欲用下图装置,利用步骤④反应,达到制备FeCO3的目的。
i. NH4HCO3溶液应盛放在装置(填字母) 中。 该装置中涉及的主要反应的离子方程式。
ii.达成步骤④反应的操作是。
(5)、测定步骤②中所得晶体中FeSO4·7H2O的质量分数:称取ag晶体样品,配成100.00 mL溶液,取出25.00 mL溶液,用硫酸酸化的0. 1000 mol/L KMnO4标准溶液滴定(杂质不与KMnO4溶液反应)。平行有效实验滴定消耗KMnO4溶液体积的平均值为20.00 mL。则所得晶体中FeSO4·7H2O的质量分数为(设M(FeSO4·7H2O)= b g/mol,用含a、b的表达式表示)。
四、综合题
-
10. 合成氨在生产中具有重要意义。请按要求回答下列问题。(1)、已知反应N2(g)+3H2(g) 2NH3(g) △H<0。向恒温恒容密闭的反应容器中投料1 mol N2、3 mol H2 , 在不同温度下分别达平衡时,混合气中NH3的物质的量分数随压强变化的曲线如图所示:

①曲线A、B、C对应的温度是由低到高依次是(填代表曲线的字母)。
图中X、Y、Z点的平衡常数大小关系(填“>”“<”或“=”): K(X) K(Y)K(Z).
②既能加快化学反应速率有能提高H2的转化率的措施有。
③Y点对应的H2的转化率是;若仅将起始投料均加倍,其他条件不变,达新平衡时,则H2的转化率将会(填“升高”、“降低”或“不变”) 。
(2)、电解法合成氨因其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图甲和图乙所示:
①图甲a电极上的电极反应式为图乙d电极上的电极反应式为。
②若图甲和图乙装置的通电时间相同、电流强度相等,电解效率分别为80%和60%,则两种装置中产生氨气的物质的量之比为。
-