四川省广安、眉山、内江、遂宁2017-2018学年高考理综-化学三模考试试卷
试卷更新日期:2018-06-13 类型:高考模拟
一、单选题
-
1. 化学与生产生活密切相关。下列有关说法正确的是( )A、用菜籽油浸泡辣椒涉及萃取知识 B、玻璃容器可以长期盛放各种酸 C、用氨做制冷剂是因为氨极易溶于水 D、不锈钢的防腐原理与电化学有关2. 下列有关有机物的说法错误的是( )A、淀粉水解可以制取葡萄糖 B、2-甲基丁烷又名异丁烷 C、苯和乙酸均能发生取代反应 D、C3H6有2种同分异构体且其化学性质不同3. 常温下,下列各组离子一定能在指定溶液中大量共存的是( )A、使酚酞显红色的溶液中:Na+、 Al3+、SO42-、Cl- B、 =1×1012的溶液中:NH4+、Na+、CO32-、SiO32- C、c(Fe2+)=1 mol·L-1的溶液中:Mg2+、H+、MnO4-、SO42- D、无色透明溶液中:K+、Ca2+、Cl-、HCO3-4. 短周期元素W、X、Y、Z的原子序数依次增大,W的一种核素在考古时常用来鉴定一些文物的年代,X2-和Y3+具有相同的电子层结构,Z原子的最外层电子数是其电子层数的2倍。下列相关说法错误的是( )A、简单氢化物的稳定性:W<X B、单核阴离子还原性:Z>X C、电解Y的熔融氧化物可制备Y单质 D、WZ2分子中只存在共价键5. 在实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程(如图),乙醛在两电极分别转化为乙醇和乙酸。下列对电解过程的分析正确的是( )
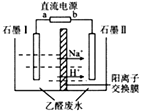 A、以铅蓄电池为电源,则a极为Pb电极 B、石墨Ⅱ电极附近的pH逐渐减小 C、阳极反应为CH3CHO+H2O-2e-=CH3COOH+2H+ D、每处理含8.8g乙醛的废水,转移电子的数目为0.4NA6. 常温下,用0. 1000 mol·L-1的盐酸滴定20.00mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示(饱和H2CO3溶液pH=5.6)。下列有关叙述正确的是( )
A、以铅蓄电池为电源,则a极为Pb电极 B、石墨Ⅱ电极附近的pH逐渐减小 C、阳极反应为CH3CHO+H2O-2e-=CH3COOH+2H+ D、每处理含8.8g乙醛的废水,转移电子的数目为0.4NA6. 常温下,用0. 1000 mol·L-1的盐酸滴定20.00mL未知浓度的Na2CO3溶液,溶液的pH与所加盐酸的体积关系如图所示(饱和H2CO3溶液pH=5.6)。下列有关叙述正确的是( )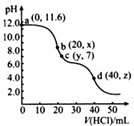 A、若c(Na2CO3)=0.1000 mol·L-1 , 则H2CO3的Ka2数量级约为10-6 B、c点处溶液中一定有:c(Na+)=2c(CO32-)+c(HCO3-) C、a、c两点水的c(OH-)之比为10-11.6 :10-7 D、若z=5.6,则d点有c(Na+)=c(Cl-)>c(H2CO3)>c(OH-)7. 某研究小组为了探究NaClO溶液的性质,设计了下列实验,并记录实验现象。
A、若c(Na2CO3)=0.1000 mol·L-1 , 则H2CO3的Ka2数量级约为10-6 B、c点处溶液中一定有:c(Na+)=2c(CO32-)+c(HCO3-) C、a、c两点水的c(OH-)之比为10-11.6 :10-7 D、若z=5.6,则d点有c(Na+)=c(Cl-)>c(H2CO3)>c(OH-)7. 某研究小组为了探究NaClO溶液的性质,设计了下列实验,并记录实验现象。实验装置
实验序号
滴管试剂
试管试剂
实验现象
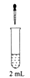
①
0.2 mol/L
NaClO溶液
饱和Ag2SO4溶液
产生白色沉淀
②
CH3COOH溶液
光照管壁有无色气泡
③
0.2mol/LFeSO4酸性溶液和KSCN溶液
溶液变红
④
0.2mol/L的AlCl3溶液
产生白色沉淀
则以下判断错误的是( )
A、实验①:发生的反应为Ag++ClO-+H2O=AgCl↓+2OH- B、实验②:无色气体为O2 C、实验③:还原性强弱顺序Fe2+>Cl- D、实验④:ClO-与Al3+的水解相互促进二、综合题
-
8. 钼酸钠晶体(Na2MoO4·2H2O)可抑制金属腐蚀。以钼精矿(主要成分为MoS2 , 含少量杂质)为原料,制备钼酸钠晶体的主要流程图如下。
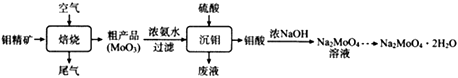
回答下列问题
(1)、完成下列反应:MoS2+ O2 SO2+ MoO3在焙烧炉中,空气从炉底进入矿石经粉碎后从炉顶进入,这样处理的目的是。
(2)、浓氨水浸取粗产品获得(NH4)2MoO4溶液,其化学反应方程式为;该反应说明MoO3(填“有”或“没有”)酸性氧化物的性质。(3)、常温下,沉钼阶段所得废液为(NH4)2SO4稀溶液。若(NH4)2SO4稀溶液的pH=a,则 =(用含a的代数式表示,NH3·H2O的Kb=1.8×10-5),若将此稀溶液蒸发浓缩, 将(填“变大”“不变”或“变小”)。(4)、已知钼酸钠在一定温度范围内的析出物质及相应物质的溶解度如下表所示,获得Na2MoO4·2H2O的操作为。温度(℃)
0
4
9
10
15.5
32
51.5
100
析出物质
Na2MoO4·10H2O
Na2MoO4·2H2O
溶解度
30.63
33.85
38.16
39.28
39.27
39.82
41.27
45.
结晶得到的母液可以在下次结晶时重复使用,但达到一定次数后必须净化处理,原因是。
(5)、空气中钼酸盐对碳钢的缓蚀原理是在钢铁表面形成FeMoO4-Fe2O3保护膜,在密闭式循环冷却水系统中的碳钢管道缓蚀,除需加入钼酸盐外还需加入的物质是___________(填选项字母)。A、NaNO2 B、通入适量N2 C、油脂 D、盐酸9. 亚硝酰氯(NOCl)是有机合成中的重要试剂。回答下列问题:(1)、NOCl虽然不稳定,但其原子均达到8e-稳定结构,NOCl的电子式为。(2)、一定条件下,在密闭容器中发生反应:2NOCl(g) 2NO(g)+Cl2(g),其正反应速率表达式为v正=k·cn( NOCl)(k为速率常数),测得v正和c(NOCl)的关系如表:序号
c(NOCl)/(mol·L-1)
v正/(mol·L-1·s-1)
①
0.30
3.60×10-9
②
0.60
1.44×10-8
则n=;k=。
(3)、25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:序号
热化学方程式
平衡常数
①
2NO2(g)+NaCl(s) NaNO3(s)+NOCl(g) ΔH1=a kJ/mol
K1
②
4NO2(g)+2NaCl(s) 2NaNO3(s)+ 2NO(g)+Cl2(g) ΔH2=b kJ/mol
K2
③
2NO(g)+Cl2(g) 2NOCl(g) ΔH3
K3
则该温度下,ΔH3=kJ/mol;K3=(用K1和K2表示)。
(4)、25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图曲线a所示,则ΔH3=(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强(p)随时间(t)的变化如图曲线b所示,则改变的条件是;K3=L/mol;在5 min时,再充入0.08 mol NO和0.04 molCl2 , 则混合气体的平均相对分子质量将(填“增大”、“减小”或“不变”)。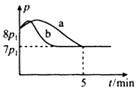 10. 氨基甲酸铵(NH2COONH4)是重要的氨化剂,分解温度40℃,遇水水解为碳酸氢铵。某研究小组欲探究NH2COONH4的制备与性质。(1)、Ⅰ.实验室制备NH2COONH4
10. 氨基甲酸铵(NH2COONH4)是重要的氨化剂,分解温度40℃,遇水水解为碳酸氢铵。某研究小组欲探究NH2COONH4的制备与性质。(1)、Ⅰ.实验室制备NH2COONH4反应原理:2NH3(g)+CO2(g)=NH2COONH4(s) ΔH<0。
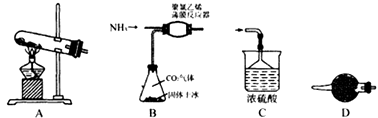
装置A中发生的化学反应方程式为。
(2)、上述装置的连接顺序为A→→→;D装置所盛放的试剂为 , C中三角漏斗的作用是。(3)、Ⅱ.制备实验的改进有人提出利用下列装置代替聚氯乙烯薄膜反应器。
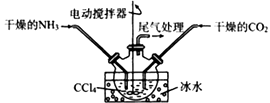
该装置的优点是、。结合化学反应方程式解释不能用水代替CCl4的原因是;当大量固体物质悬浮于CCl4上时即可停止反应,分离出产品的方法是。
(4)、Ⅲ.对NH2COONH4产物成分的探究已知,制备过程中因温度控制不当,在150℃时会产生尿素。如果对参加反应的气体干燥不彻底可能会有NH4HCO3、(NH4)2CO3杂质生成。
①请设计简单实验方案探究上述产物中是否有尿素。
②请设计定量实验方案探究上述产物(假设不存在NH4HCO3)中是否有碳酸铵。
(以上方案均不需详细描述实验步骤,限用试剂:蒸馏水、Ba(OH)2溶液;仪器自选)
11. 铁是重要的工业元素。(1)、铁元素位于周期表中的区,Fe的外围电子排布的轨道表示式为 , Fe的7个能级中能量最高的是。(2)、(NH4)2Fe(SO4)2·6H2O俗称摩尔盐,其中H2O的VSEPR模型名称为。写出一种与SO42-互为等电子体的分子的化学式。(3)、金属Fe具有导电性,温度越高其导电性越 , 其原因是。(4)、ZnCl2浓溶液常用于除去Fe表面的氧化物,反应可得[Zn(OH)2Cl2]2-溶液。[Zn(OH)2Cl2]2-中肯定不存在的微粒间作用力有(填选项字母);A.离子键 B.共价键 C.金属键 D.配位键 E.范德华力
画出溶液中[Zn(OH)2Cl2]2-的结构式,并表示出配位键。
(5)、某种磁性氮化铁的结构如图所示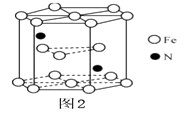 ,Fe为堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为 ,则该化合物的化学式为。 其中铁原子最近的铁原子的个数为;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为g·cm-3(用含a、c和NA的计算式表示)。 12. E是一种环保型塑料,其合成路线如下:
,Fe为堆积,N随机排列在Fe构成的正四面体空隙中,空隙的占有率为 ,则该化合物的化学式为。 其中铁原子最近的铁原子的个数为;氮化铁晶胞底边长为a nm,高为c nm,则这种磁性氮化铁的晶体密度为g·cm-3(用含a、c和NA的计算式表示)。 12. E是一种环保型塑料,其合成路线如下: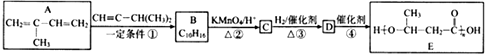
已知:①
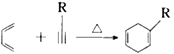
②
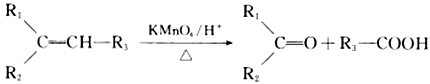 (R1、R2、R3、R为烃基)
(R1、R2、R3、R为烃基)请回答下列问题:
(1)、A中官能团的名称是 , 检验该官能团的试剂为。(2)、反应①的化学方程式是: , 其反应类型为 , 在反应①中,还可以得到另一种分子式为C10H16的化合物,其结构简式为。(3)、已知,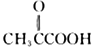 名称为丙酮酸,则C的系统命名法命名应为。 (4)、写出反应④的化学方程式:。(5)、C的同分异构体X满足下列条件:
名称为丙酮酸,则C的系统命名法命名应为。 (4)、写出反应④的化学方程式:。(5)、C的同分异构体X满足下列条件:①常温下,与碳酸钠溶液反应放出气体;
②能发生银镜反应。则符合条件的X共有种。其核磁共振氢谱共有四组峰且峰面积之比为1∶1∶2∶2,则X的结构简式为。
(6)、参照E的上述合成路线,设计一条由4一甲基一3一戊酮酸为起始原料制备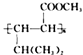 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。