四川省成都市2017-2018学年高考理综-化学三模考试试卷
试卷更新日期:2018-06-13 类型:高考模拟
一、单选题
-
1. 化学与社会、生活密切相关。对下列物质用途解释错误的是( )
选项
用途
解释
A
钛合金可用于人造卫星等领域
钛合金具有密度小、熔点高等特点
B
明矾在净水中作絮凝剂
明矾具有氧化性,可消毒杀菌
C
生石灰可作煤炭燃烧的固硫剂
生石灰可与煤燃烧生成的SO2反应
D
维生素C在食品工业中可作抗氧剂
维生素C具有还原性
A、A B、B C、C D、D2. 某有机玻璃的单体分子(只含C、H、O元素)结构模型如图所示。下列分析正确的是( )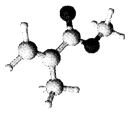 A、该分子所有原子可能共面 B、与该单体互为同分异构体的羧酸类有4种 C、该有机高分子的链节为
A、该分子所有原子可能共面 B、与该单体互为同分异构体的羧酸类有4种 C、该有机高分子的链节为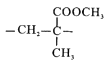 D、该有机玻璃容器可贮存强酸强碱溶液
3. 常温下,设NA为阿伏加德罗常数的值。下列叙述正确的是( )A、1mol D3O+中含中子数目为10NA B、一定条件下1molN2与4molH2充分反应后,所得混合物中极性键数目为6NA C、在100.0mL浓度均为0.1mol/L的NaOH和Na2CO3的混合溶液中逐滴加入50.0mL0.5mol/L稀盐酸,生成CO2气体分子数目为0.01NA D、在1.0L含有Na+、K+、Cl-、CO32-的溶液中,H+数目小于1.0×10-7NA4. 短周期主族元素A、B、C、D的原子序数依次增大。甲、乙、丙、丁、戊是由这些元素组成的常见化合物,其中丙、丁、戊为二元化合物,已是元素C的单质。甲、乙的溶液均呈碱性。下列说法错误的是( )
D、该有机玻璃容器可贮存强酸强碱溶液
3. 常温下,设NA为阿伏加德罗常数的值。下列叙述正确的是( )A、1mol D3O+中含中子数目为10NA B、一定条件下1molN2与4molH2充分反应后,所得混合物中极性键数目为6NA C、在100.0mL浓度均为0.1mol/L的NaOH和Na2CO3的混合溶液中逐滴加入50.0mL0.5mol/L稀盐酸,生成CO2气体分子数目为0.01NA D、在1.0L含有Na+、K+、Cl-、CO32-的溶液中,H+数目小于1.0×10-7NA4. 短周期主族元素A、B、C、D的原子序数依次增大。甲、乙、丙、丁、戊是由这些元素组成的常见化合物,其中丙、丁、戊为二元化合物,已是元素C的单质。甲、乙的溶液均呈碱性。下列说法错误的是( ) A、甲和戊加入水中都能破坏水的电离平衡 B、乙和戊都含有离子键 C、原子半径r(D)>r(B)>r(C)>r(A) D、A,B,C形成的化合物一定显酸性5. 控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是( )
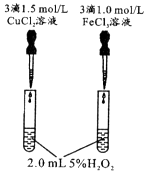
A、甲和戊加入水中都能破坏水的电离平衡 B、乙和戊都含有离子键 C、原子半径r(D)>r(B)>r(C)>r(A) D、A,B,C形成的化合物一定显酸性5. 控制变量是科学研究重要方法。由下列实验现象一定能得出相应结论的是( )选项
A
B
装
置
图

现象
右边试管产生气泡较快
左边棉球变棕黄色,右边棉球变蓝色
结论
催化活性:Fe3+>Cu2+
氧化性:Br2>I2
选项
C
D
装
置
图
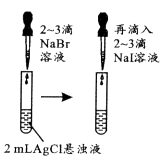
现象
试管中先出现淡黄色固体,后出现黄色固体
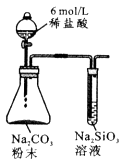
试管中液体变浑浊
结论
Ksp:AgCl>AgBr>AgI
非金属性:C>Si
A、A B、B C、C D、D6. 载人空间站为了循环利用人体呼出的CO2并将其转化为O2 , 设计装置工作原理如图所示,以实现“太阳能能→电能→化学能”的转化。总反应为2CO2=2CO+O2。下列说法正确的是( )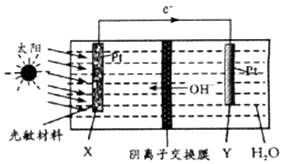 A、该装置属于原电池 B、水在Y电极参与反应 C、反应完毕,该装置中电解质溶液碱性增强 D、X极反应:O2+2H2O+4e-=4OH-7. 已知H2A为二元弱酸,室温下向100.0mL0.1mol/LH2A溶液中加入不同质量的NaOH固体,pH变化如下表(不考虑溶液体积变化)。下列分析正确的是( )
A、该装置属于原电池 B、水在Y电极参与反应 C、反应完毕,该装置中电解质溶液碱性增强 D、X极反应:O2+2H2O+4e-=4OH-7. 已知H2A为二元弱酸,室温下向100.0mL0.1mol/LH2A溶液中加入不同质量的NaOH固体,pH变化如下表(不考虑溶液体积变化)。下列分析正确的是( )m(NaOH)/g
0
0.4
0.8
1.2
pH
3.8
8.3
12.0
13.2
A、H2A第一步电离K1的数量级为10-8 B、上述过程中水的电离程度一直增大 C、m(NaOH)=0.6g时,c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+) D、若溶液中加NaOH至 时,c(OH-)>100c(H+)二、填空题
-
8. 研究NO2、NO、CO污染物处理,对建设美丽中国具有重要意义。(1)、①NO2(g)+CO(g)=CO2(g)+NO(g) △H1=-234.00kJ/mol
②1/2N2(g)+1/2O2(g)=NO(g) △H2=-89.75kJ/mol
③2NO(g)+O2(g)=2NO2(g) △H3=-112.30kJ/mol。
若NO2气体和CO气体反应生成无污染气体,其热化学方程式为。
(2)、某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生反应:2NO2(g)+4CO(g)=N2(g)+4CO2(g) ,经10min反应达到平衡,容器的压强变为原来的 。①0~10min内,CO的平均反应速率v(CO)=;
②若容器中观察到 ,可判断该反应达到平衡状态;
③为增大污染物处理效率,起始最佳投料比为;
④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡(填“右移”或“左移”或“不移动”)。
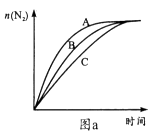
(3)、在高效催化剂作用下用NH3还原NO2进行污染物处理。①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是(用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。
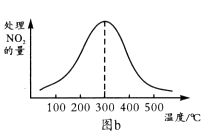
②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因(假设该温度范围内催化效率相同)。
 (4)、有人设想在含有NO2的酸性污水中加入填充有铝粉的多孔活性炭颗粒进行水的净化。试结合电极反应说明多孔活性炭的主要作用。9. C、Ti的单质及其化合物在现代社会有广泛用途。(1)、基态钛原子的电子排布式为。(2)、CS2分子中含有σ键和π键之比为;NO2+与CO2是等电子体,NO2+的电子式为 ,键角为。(3)、CH3CHO沸点低于CH3CH2OH的原因是 ;CH3 CHO分子中碳原子杂化类型为。(4)、钛酸钡(BaTiO3)晶体的某种晶胞如图所示。NA为阿伏加德罗常数值,Ba2+、O2-、Ti4+的半径分别为a pm、b pm、c pm。
(4)、有人设想在含有NO2的酸性污水中加入填充有铝粉的多孔活性炭颗粒进行水的净化。试结合电极反应说明多孔活性炭的主要作用。9. C、Ti的单质及其化合物在现代社会有广泛用途。(1)、基态钛原子的电子排布式为。(2)、CS2分子中含有σ键和π键之比为;NO2+与CO2是等电子体,NO2+的电子式为 ,键角为。(3)、CH3CHO沸点低于CH3CH2OH的原因是 ;CH3 CHO分子中碳原子杂化类型为。(4)、钛酸钡(BaTiO3)晶体的某种晶胞如图所示。NA为阿伏加德罗常数值,Ba2+、O2-、Ti4+的半径分别为a pm、b pm、c pm。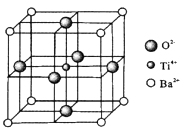
①与钡离子等距离且最近的氧离子有个;
②假设晶体中的Ti4+、Ba2+分别与O2-互相接触,则该晶体的密度表达式为g.cm-3。
三、实验题
-
10. 某小组实验探究葡萄糖、二氧化硫分别与新制氢氧化铜的反应。
实验I 新制Cu(OH)2与葡萄糖反应
(1)、将1.5mL1.0mol/LCuSO4溶液滴入5mLl.0mol/LNaOH溶液中制得Cu(OH)2悬浊液。相关反应的离子方程式为。(2)、在制得的Cu(OH)2悬浊液中加入稍过量葡萄糖溶液,加热煮沸,产生红色沉淀。①该实验现象说明;
②该原理可用于检测糖尿病患者血液中的含量。
实验II 新制Cu(OH)2与二氧化硫反应
按上述方法重新制取氢氧化铜悬浊液,通入足量二氧化硫,先产生红色沉淀,然后红色沉淀逐渐变为紫红色固体,最终溶液呈无色。
(3)、探究红色沉淀转变为紫红色的原因。将实验I产生的红色沉淀过滤、洗涤,洗涤方法是。
将所得固体分成两等份于试管中并加入少量蒸馏水进行对比实验。
实验装置图

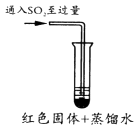
操作及现象
红色固体很快转变为紫红色固体,溶液呈蓝色。
开始红色固体缓慢变为紫红色固体,溶液呈蓝色。试管内紫红色固体逐渐增多,最后溶液变无色。
解释及结论
①该反应的离子方程式
。
②开始时红色固体颜色变化缓慢的原因是。
③所得无色溶液中主要阴离子为。
(4)、通过上述探究,写出新制氢氧化铜与过量SO2反应的总化学方程式。反思:将表中SO2换为NO2是否能观察到相同现象? 回答并解释:。
11. 某地菱锰矿的主要成分为MnCO3 , 还含有少量的FeCO3、CaCO3、MgCO3、Al2O3等杂质,工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示: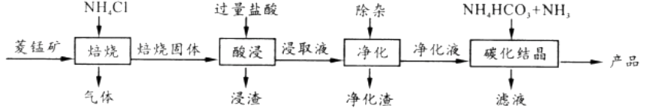
已知:MnCO3+2NH4Cl MnCl2 +CO2 ↑+2NH3 ↑+H2O↑
(1)、焙烧时温度对锰浸取率的影响如图。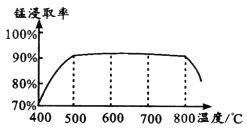
焙烧时适宜温度为;800℃以上锰的浸取率偏低,可能原因是。
(2)、净化包含三步: ①加入少量MnO2 , 反应的离子方程式为;②加氨水调pH,生成沉淀主要是;
③加入NH4F,除去Ca2+、Mg2+。
(3)、碳化结晶中生成MnCO3的离子方程式为。(4)、滴定法测产品纯度I 取固体产品1.160 g 于烧杯中,加入过量稀H2SO4充分振荡,再加入NaOH 溶液至碱性,发生反应2Mn2+ +O2 +4OH-=2MnO(OH)2;
II 加入过量KI 溶液和适量稀H2SO4 , 发生反应:MnO(OH)2 +2I-+4H+=Mn2+ + I2 +3H2O;
III 取I中混合液的1/10于锥形瓶中,加入淀粉溶液作指示剂,用0.1000 mol/LNa2S2O3溶液进行滴定,发生反应:2S2O32-+I2=S4O62-+2I- , 滴定终点时消耗Na2S2O3溶液20.00 mL。
①判断滴定终点的方法是。
②假设杂质不参与反应,则产品纯度为。
四、推断题
-
12. 狼毒素来自香科植物,具有止痛、杀虫的功效。N是合成狼毒素的重要中间体,其合成路线如下:
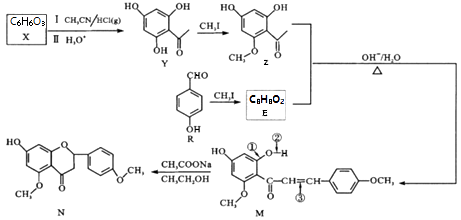 (1)、R 中含氧官能团名称;Y→Z 的反应类型。(2)、1mol Z 与NaOH 溶液反应,最多消耗NaOH 为mol;反应R→E 的化学方程式为。(3)、下列能测出N的相对分子质量的仪器是_____(填字母序号)。A、元素分析仪 B、质谱仪 C、核磁共振仪 D、红外光谱仪(4)、反应M→N 中M 的断键位置为(填数字序号)。(5)、同时满足下列条件的Y 的同分异构体有种。
(1)、R 中含氧官能团名称;Y→Z 的反应类型。(2)、1mol Z 与NaOH 溶液反应,最多消耗NaOH 为mol;反应R→E 的化学方程式为。(3)、下列能测出N的相对分子质量的仪器是_____(填字母序号)。A、元素分析仪 B、质谱仪 C、核磁共振仪 D、红外光谱仪(4)、反应M→N 中M 的断键位置为(填数字序号)。(5)、同时满足下列条件的Y 的同分异构体有种。①苯环上有3 个取代基; ②为芳香族化合物且属于酯类;
③遇氯化铁溶液显紫色; ④苯环上一氯代物有2 种。
(6)、以丙酮和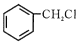 为原料合成某有机中间体(
为原料合成某有机中间体( 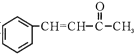 ),参照上述路线,设计路线。
),参照上述路线,设计路线。