山西省太原市2017-2018学年高考理综-化学三模考试试卷
试卷更新日期:2018-06-13 类型:高考模拟
一、单选题
-
1. 化学与科技生产、生活环境等密切相关,下列说法错误的是( )A、“霾尘积聚难见路人”,雾和霾所形成的气溶胶具有丁达尔效应 B、“天宫二号”使用的碳纤维,是一种新型有机高分子材料 C、绿色化学的核心是利用化学原理从源头上减少或消除工业生产对环境的污染 D、“一带一路”是现代丝绸之路,丝绸的主要成分是蛋白质,属于天然高分子化合物2. 南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( )
 A、海水淡化的方法主要有蒸馏法、电渗析法、冰冻法 B、氯碱工业中采用阴离子交换膜可提高产品的纯度 C、由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干 D、溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原3. 设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )A、28g乙烯和丙烯中的极性键数目为4NA B、32gCu和32gS充分反应,转移电子数为NA C、1L0.3mol·L-1Na2CO3溶液中的阴离子数目小于0.3NA D、0.2molNH3与0.3molO2在催化剂的作用下充分反应,所得NO的分子数为0.2NA4. LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池的装置示意图,图乙是LED发光二极管的装置示意图。下列叙述错误的是( )
A、海水淡化的方法主要有蒸馏法、电渗析法、冰冻法 B、氯碱工业中采用阴离子交换膜可提高产品的纯度 C、由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干 D、溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原3. 设NA为阿伏加德罗常数的值,下列有关叙述正确的是( )A、28g乙烯和丙烯中的极性键数目为4NA B、32gCu和32gS充分反应,转移电子数为NA C、1L0.3mol·L-1Na2CO3溶液中的阴离子数目小于0.3NA D、0.2molNH3与0.3molO2在催化剂的作用下充分反应,所得NO的分子数为0.2NA4. LED系列产品是一类新型节能产品。图甲是NaBH4/H2O2燃料电池的装置示意图,图乙是LED发光二极管的装置示意图。下列叙述错误的是( )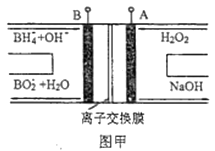
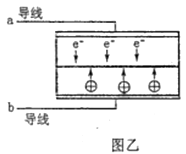 A、电池应选用阳离子交换膜,Na+向A极区移动 B、电池A极区的电极反应式为:H2O2+2e-=2OH- C、每有1molNaBH4参加反应,转移电子数为4NA D、要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连5. 短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们分别位于三个周期。Y和M同主族,火山喷口附近或地壳的岩层中存在游离态的M,X元素的最高价氧化物对应的水化物与其气态氢化物相遇会有白烟。这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向此溶液中滴加稀氢氧化钠溶液,产生沉淀的物质的量与氢氧化钠溶液体积的关系如图所示。下列说法错误的是( )
A、电池应选用阳离子交换膜,Na+向A极区移动 B、电池A极区的电极反应式为:H2O2+2e-=2OH- C、每有1molNaBH4参加反应,转移电子数为4NA D、要使LED发光二极管正常发光,图乙中的导线a应与图甲中的B极相连5. 短周期主族元素R、X、Y、Z、M的原子序数依次增大,它们分别位于三个周期。Y和M同主族,火山喷口附近或地壳的岩层中存在游离态的M,X元素的最高价氧化物对应的水化物与其气态氢化物相遇会有白烟。这五种元素组成一种离子化合物Q,取一定量Q溶于蒸馏水得到溶液,向此溶液中滴加稀氢氧化钠溶液,产生沉淀的物质的量与氢氧化钠溶液体积的关系如图所示。下列说法错误的是( ) A、简单氢化物的沸点:Y>X B、简单离子的半径:M>Y>Z C、R与除Z以外的其他3种元素均能形成共价化合物 D、Y与其他4种元素均可形成至少两种二元化合物6. 苯甲酸乙酯(C9H10O2)是无色透明有水果香气的液体,俗称安息香酸乙酯,常用做溶剂和香料。下列说法正确的是( )
A、简单氢化物的沸点:Y>X B、简单离子的半径:M>Y>Z C、R与除Z以外的其他3种元素均能形成共价化合物 D、Y与其他4种元素均可形成至少两种二元化合物6. 苯甲酸乙酯(C9H10O2)是无色透明有水果香气的液体,俗称安息香酸乙酯,常用做溶剂和香料。下列说法正确的是( ) A、按如图装置制备苯甲酸乙酯,应在烧瓶A中先加入3mL浓H2SO4和4g苯甲酸,然后边振荡烧瓶边慢慢加入10mL乙醇 B、如图是制备苯甲酸乙酯的简易装置,A中玻璃导管改用球形玲凝管效果更好 C、制得的苯甲酸乙酯粗产品,可通过水洗、NaOH溶液洗涤、水洗,除去苯甲酸乙酯中的部分杂质 D、分子式为C9H10O2 , 含有苯环且能与饱和NaHCO3溶液反应放出气体的有机物共有15种(不含立体异构)7. 已知常温下,Ka1(H2CO3)=4.3×10-7 , Ka2(H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述错误的是( )
A、按如图装置制备苯甲酸乙酯,应在烧瓶A中先加入3mL浓H2SO4和4g苯甲酸,然后边振荡烧瓶边慢慢加入10mL乙醇 B、如图是制备苯甲酸乙酯的简易装置,A中玻璃导管改用球形玲凝管效果更好 C、制得的苯甲酸乙酯粗产品,可通过水洗、NaOH溶液洗涤、水洗,除去苯甲酸乙酯中的部分杂质 D、分子式为C9H10O2 , 含有苯环且能与饱和NaHCO3溶液反应放出气体的有机物共有15种(不含立体异构)7. 已知常温下,Ka1(H2CO3)=4.3×10-7 , Ka2(H2CO3)=5.6×10-11。某二元酸H2R及其钠盐的溶液中,H2R、HR-、R2-三者的物质的量分数随溶液pH变化关系如图所示,下列叙述错误的是( ) A、在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-) B、等体积、等浓度的NaOH溶液与H2R溶液混合后,此溶液中水的电离程度比纯水小 C、等浓度的NaOH溶液与H2R溶液按体积比1∶2混合,溶液的pH=1.3 D、向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO32-+H2R=2HCO3-+R2-
A、在pH=4.3的溶液中:3c(R2-)=c(Na+)+c(H+)-c(OH-) B、等体积、等浓度的NaOH溶液与H2R溶液混合后,此溶液中水的电离程度比纯水小 C、等浓度的NaOH溶液与H2R溶液按体积比1∶2混合,溶液的pH=1.3 D、向Na2CO3溶液中加入少量H2R溶液,发生反应:2CO32-+H2R=2HCO3-+R2-二、综合题
-
8. 三氯氧磷(POCl3)常用作半导体掺杂剂及光导纤维原料,实验室制备POCl3并测定产品含量的实验过程如下:
Ⅰ.制备POCl3。
采用氧气氧化液态PCl3法制取POCl3 , 实验装置(加热及夹持仪器略)如图所示:

已知:①Ag++SCN-=AgSCN↓;Ksp(AgCl)> Ksp(AgSCN);磷酸银溶于硝酸。
②PCl3和POCl3的相关信息如下表:
物质
熔点/℃
沸点/℃
相对分子质量
其他
PCl3
-112.0
76.0
137.5
两者互溶,均为无色液体,遇水均剧烈反应生成含氧酸和氯化氢
POCl3
2.0
106.0
153.5
(1)、POCl3遇水反应的化学方程式为。(2)、装置B的作用除干燥O2外,还有。干燥管的作用是。(3)、反应温度要控制在60~65℃,原因是。(4)、Ⅱ.测定POCl3产品的含量。实验步骤:
①制备POCl3实验结束后,待三颈烧瓶中的液体冷却至室温,准确称取30.7gPOCl3产品,置于盛有60.00 mL蒸馏水的水解瓶中摇动至完全水解,将水解液配成100.00 mL溶液。
②取10.00 mL溶液于锥形瓶中,加入10.00 mL3.2 mol/L AgNO3标准溶液。
③加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖。
④以X为指示剂,用0.2 mol/L KSCN溶液漓定过量的AgNO3溶液,达到滴定终点时共用去10.00 mL KSCN溶液。
步骤③中加入硝基苯的作用是。若无此操作,所测产品中氯元素的质量分数将会(填“偏大”、“偏小”或“不变”)。
(5)、步骤④中X为 , 产品中POCl3的质量分数为。9. “绿水青山就是金山银山”,近年来,绿色发展、生态保护成为中国展示给世界的一张新“名片”。汽车尾气是造成大气污染的重要原因之一,减少氮的氧化物在大气中的排放是环境保护的重要内容之一。请回答下列问题:(1)、已知:N2(g)+O2(g)=2NO(g) △H1= +180.5 kJ/molC(s)+O2(g)=CO2(g) △H2=-393.5 kJ/mol
2C(s)+O2(g)=2CO(g) △H3=-221 kJ/mol
若某反应的平衡常数表达式为:K= [c(N2) ·c2(CO2)]/[c2(NO) ·c2(CO)],则此反应的热化学方程式为。
(2)、N2O5在一定条件下可发生分解:2N2O5(g)=4NO2(g)+O2(g),某温度下恒容密闭容器中加入一定量N2O5 , 测得N2O5浓度随时间的变化如下表:t/ min
0
1
2
3
4
5
c(N2O5)/<mol·L-1)
1.00
0.71
0.50
0.35
0.25
0.17
①反应开始时体系压强为p0 , 第2 min时体系压强为p1 , 则p1∶p0=。2~5 min内用NO2表示的该反应的平均反应速率为。
②一定温度下,在恒容密闭容器中充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是。(填字母)。
a.NO2和O2的浓度比保持不变
b.容器中压强不再变化
c.2v正(NO2)=v逆(N2O5)
d.气体的密度保持不变
(3)、Kp是用反应体系中气体物质的分压来表示的平衡常数,即将K表达式中平衡浓度用平衡分压代替。已知反应:NO2(g)+CO(g)=NO(g)+CO2(g),该反应中正反应速率v正=k正·p(NO2)·p(CO),逆反应速率v逆=k逆·p(NO)·p(CO2),其中k正、k逆为速率常数,则Kp为(用 k正、k逆表示)。(4)、如图是密闭反应器中按n(N2) ∶n(H2)=1∶3投料后,在200℃、400℃、600℃下,合成NH3反应达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线,已知该反应为放热反应。
①曲线a对应的温度是。
②M点对应的H2的转化率是。
(5)、工业上常用氨水吸收二氧化硫,可生成(NH4)2SO3。判断常温下(NH4)2SO3溶液的酸碱性并说明判断依据:。(已知:NH3·H2O的Kb=1.8×10-5;H2SO3的Ka1=1.3×10-2 , Ka2=6.3×10-8。)10. 铋(Bi)与氮同族,氯氧化铋(BiOCl)广泛用于彩釉调料、塑料助剂、油漆调色、生产金属铋等。一种以用火法炼铜过程产生的铜转炉烟尘(除含铋的化合物之外,还有CuSO4、ZnSO4、CuS、Fe2O3、PbSO4及As2O3)制备高纯氯氧化铋的工艺流程如下:
请回答:
(1)、BiOCl中Bi元素的化合价为。(2)、向“酸浸”所得“浸液1”中加入Zn粉,主要目的是。(3)、“浸铜”时,有单质硫生成,其反应的离子方程式为。(4)、“浸铋”时,温度升高,铋的浸出率降低,其原因为。(5)、“沉铋”时需控制溶液的pH=3.0,此时BiCl3发生反应的化学方程式为。(6)、“除铅、砷”时,可以采用以下两种方法:①加入改性羟基磷灰石固体(HAP):浸液2与HAP的液固比(L/S)与铅、砷去除率以及后续沉铋量的关系如下表:
L/S
125∶1
50∶1
25∶1
15∶1
Pb2+去除率/%
84.86
94.15
95.40
96.83
As3+去除率/%
98.79
98.92
98.34
99.05
m(沉铋)/g
2.34
2.33
2.05
1.98
实验中应采用的L/S=。
②铁盐氧化法:向浸液2中加入Fe2(SO4)3 , 并调节pH,生成FeAsO4沉淀。当溶液中c(AsO43-)=1×10-9 mol/L,且不产生Fe(OH)3沉淀,此时溶液的pH为。(已知:1g2=0.3;FeAsO4、Fe(OH)3的Ksp分别为5×10-21、4×10-38。)
11. 党的十八大以来,我国在科技创新和重大工程建设方面取得了丰硕成果,在新时代更需要新科技创新世界。2018年3月5日,《自然》连刊两文报道石墨烯超导重大发现,第一作者均为中国科大10级少年班现年仅21岁的曹原。曹原团队在双层石墨烯中发现新的电子态,可以简单实现绝缘体到超导体的转变。石墨烯是一种由碳原子组成六角形呈蜂巢晶格的二维碳纳米材料(如图甲),石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图乙)。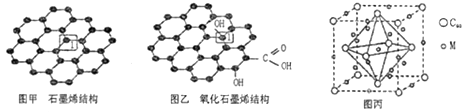 (1)、图甲中,1号C与相邻C形成σ键的个数为。(2)、图乙中,1号C的杂化方式是 , 该C与相邻C形成的键角(填“>”、“<”或“=”)图甲中1号C与相邻C形成的键角。(3)、我国制墨工艺是将50 nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是。(4)、石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为 , 该材料的化学式为。(5)、金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为。(6)、一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
(1)、图甲中,1号C与相邻C形成σ键的个数为。(2)、图乙中,1号C的杂化方式是 , 该C与相邻C形成的键角(填“>”、“<”或“=”)图甲中1号C与相邻C形成的键角。(3)、我国制墨工艺是将50 nm左右的石墨烯或氧化石墨烯溶于水,在相同条件下所得到的分散系后者更为稳定,其原因是。(4)、石墨烯可转化为富勒烯(C60),某金属M与C60可制备一种低温超导材料,晶胞如图丙所示,M原子位于晶胞的棱心与内部。该晶胞中M原子的个数为 , 该材料的化学式为。(5)、金刚石与石墨都是碳的同素异形体。若碳原子半径为r,金刚石晶胞的边长为a,根据硬球接触模型,金刚石晶胞中碳原子的空间占有率为。(6)、一定条件下,CH4、CO2都能与H2O形成笼状结构(如下图所示)的水合物晶体,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。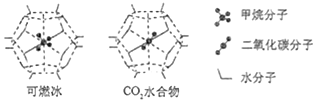
①“可燃冰”中分子间存在的2种作用力是;
②为开采深海海底的“可燃冰",有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586 nm,结合图表从物质结构及性质的角度分析,该设想的依据是:。
参数
分子
分子直径/nm
分子与H2O的结合能E/(kJ·mol-1)
CH4
0.436
16.40
CO2
0.512
29.91
三、推断题
-
12. 芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:

已知:
①A的苯环上只有一个支链,支链上有两种不同环境的氢原子
②
 +CO2
+CO2③RCOCH3+R'CHO RCOCH=CHR'+H2O
回答下列问题:
(1)、A生成B的反应类型为 , 由D生成E的反应条件为。(2)、H中含有的官能团名称为。(3)、I的结构简式为。(4)、由E生成F的化学方程式为。(5)、F有多种同分异构体,写出一种符合下列条件的同分异构体的结构简式为:。①能发生水解反应和银镜反应
②属于芳香族化合物且分子中只有一个甲基
③具有5组核磁共振氢谱峰
(6)、糠叉丙酮( )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(  )为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):。
)为原料制备糠叉丙酮的合成路线(无机试剂任选,用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件):。