山东省烟台市2017-2018学年高考理综-化学二模考试试卷
试卷更新日期:2018-06-13 类型:高考模拟
一、单选题
-
1. 化学与生活、社会发展息息相关,下列记载或叙述错误的是( )A、“丹砂烧之成水银,积变又成丹砂”,是因为加热丹砂(HgS)熔融成液态,冷却时重新结晶成HgS晶体 B、“霾尘积聚难见路人”,雾霾所形成的气溶胶能产生丁达尔效应 C、“曾青涂铁,铁赤色如铜”(“曾青”是指硫酸铜),记载中的反应属于置换反应 D、“用浓酒和糟入甑(蒸锅),蒸令气上,用器承滴露”,涉及的操作是蒸馏2. 用NA表示阿伏加德罗常数的值,下列叙述正确的是( )A、18g D2O和18g H2O中含有的质子数均为10NA B、1mol LiAlH4在125℃完全分解成LiH、H2、Al,转移电子数为3NA C、向100mL 1mol·L-1 Fe(NO3)3溶液中滴加足量HI溶液,转移0.1NA个电子 D、密闭容器中1mol N2与3mol H2充分反应生成6NA个N-H键3. 枸橼酸是一种弱有机酸,是柑橘类水果中产生的一种天然防腐剂,也是食物和饮料中的酸味添加剂。其结构简式如下图所示,下列有关说法正确的是( )
 A、枸橼酸与乙二酸属于同系物 B、化学式为C7H8O7 C、1mol枸橼酸最多消耗4molNaOH D、1mol枸橼酸最多能与3mol乙醇发生酯化反应4. X、Y、Z、W是原子序数依次增大的短周期主族元素。Z与Y、W在周期表中处于相邻位置;由Z、W形成的一种化合物可与X、W形成的化合物反应,生成淡黄色固体。下列推断错误的是( )A、Y、Z、W的简单氢化物中Z的氢化物稳定性最强 B、X、Y、Z三种元素间既能形成共价化合物,也能形成离子化合物 C、离子半径:X<Y<Z<W D、含W的钠盐溶液可能呈酸性、碱性或中性5. 下列实验操作、实验现象和实验结论均正确的是( )
A、枸橼酸与乙二酸属于同系物 B、化学式为C7H8O7 C、1mol枸橼酸最多消耗4molNaOH D、1mol枸橼酸最多能与3mol乙醇发生酯化反应4. X、Y、Z、W是原子序数依次增大的短周期主族元素。Z与Y、W在周期表中处于相邻位置;由Z、W形成的一种化合物可与X、W形成的化合物反应,生成淡黄色固体。下列推断错误的是( )A、Y、Z、W的简单氢化物中Z的氢化物稳定性最强 B、X、Y、Z三种元素间既能形成共价化合物,也能形成离子化合物 C、离子半径:X<Y<Z<W D、含W的钠盐溶液可能呈酸性、碱性或中性5. 下列实验操作、实验现象和实验结论均正确的是( ) A、A B、B C、C D、D6. 比亚迪纯电动汽车采用一种具有高效率输出、可快速充电、对环境无污染等优点新型电池,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,聚合物交换膜只允许Li+通过,而e-不能通过。电池反应式为LixC6+Li1-xFePO4 LiFePO4+6C。下列说法错误的是( )
A、A B、B C、C D、D6. 比亚迪纯电动汽车采用一种具有高效率输出、可快速充电、对环境无污染等优点新型电池,其工作原理如图。M电极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,聚合物交换膜只允许Li+通过,而e-不能通过。电池反应式为LixC6+Li1-xFePO4 LiFePO4+6C。下列说法错误的是( ) A、放电时,N极是正极,电极反应式为Li(1-x)FePO4+xLi++xe-=LiFePO4 B、充电时,Li+通过聚合物交换膜向M极迁移 C、用该电池电解精炼铜,阴极质量增重19.2g时,通过聚合物交换膜的Li+数目为0.6NA D、充电时电路中通过0.5mol e- , 消耗36gC7. 室温下,向三种浓度相同的弱酸HX、HY、HZ中分别滴加相同浓度的NaOH溶液,溶液pH与中和百分数变化曲线如图所示,下列判断错误的是( )
A、放电时,N极是正极,电极反应式为Li(1-x)FePO4+xLi++xe-=LiFePO4 B、充电时,Li+通过聚合物交换膜向M极迁移 C、用该电池电解精炼铜,阴极质量增重19.2g时,通过聚合物交换膜的Li+数目为0.6NA D、充电时电路中通过0.5mol e- , 消耗36gC7. 室温下,向三种浓度相同的弱酸HX、HY、HZ中分别滴加相同浓度的NaOH溶液,溶液pH与中和百分数变化曲线如图所示,下列判断错误的是( ) A、三种酸的电离常数关系:Ka(HX)>Ka(HY)>Ka(HZ) B、图中A点时溶液中离子浓度大小关系:c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-) C、pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-) D、当中和百分数达100%时,将三种溶液混合后:c(HX)+c(HY)+c(HZ)=c(OH-)-c(H+)
A、三种酸的电离常数关系:Ka(HX)>Ka(HY)>Ka(HZ) B、图中A点时溶液中离子浓度大小关系:c(Y-)>c(Na+)>c(HY)>c(H+)>c(OH-) C、pH=7时,三种溶液中:c(X-)=c(Y-)=c(Z-) D、当中和百分数达100%时,将三种溶液混合后:c(HX)+c(HY)+c(HZ)=c(OH-)-c(H+)二、实验题
-
8. 实验室欲测定铁铝合金的组成,将铁铝合金溶解后,取试样25.00mL,分离并测定Fe3+的浓度,实验方案设计如下:

已知:乙醚易挥发,易燃烧。
回答下列问题:
(1)、常温下,将铁铝合金溶解的试剂是(填字母)。a.稀盐酸
b.稀硫酸
c.稀硝酸
d.浓硝酸
(2)、已知氢氧化铁实际上是三氧化二铁的水合物,则通过称量氢氧化铁固体质量的方法来确定c(Fe3+)时,该方案理论上的主要缺点是。(3)、操作X是 , 操作X后检验溶液中是否有Fe3+残留的方法是。(4)、蒸馏装置如图所示,装置中存在的错误是。 (5)、将含Fe3+的溶液定容至100mL需要的仪器是。(6)、已知滴定反应为Ce4++Fe2+=Ce3++Fe3+ , 当滴定达到终点时,消耗0.1000 mol·L-1Ce(SO4)2溶液15.00 mL,则开始试样中c(Fe3+)=。若改用稀硫酸酸化的K2Cr2O7溶液滴定含Fe2+的待测液,则该过程的离子反应方程式为。9. 某科研小组以废旧的含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)为原料制取Ni2O3 , 工艺流程如下图:
(5)、将含Fe3+的溶液定容至100mL需要的仪器是。(6)、已知滴定反应为Ce4++Fe2+=Ce3++Fe3+ , 当滴定达到终点时,消耗0.1000 mol·L-1Ce(SO4)2溶液15.00 mL,则开始试样中c(Fe3+)=。若改用稀硫酸酸化的K2Cr2O7溶液滴定含Fe2+的待测液,则该过程的离子反应方程式为。9. 某科研小组以废旧的含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)为原料制取Ni2O3 , 工艺流程如下图:
相关离子生成氢氧化物的pH和相关物质的溶解性如下表:

回答下列问题:
(1)、滤渣的主要成分为BaSO4和(填化学式)。(2)、操作A中发生反应的离子方程式为Cu2++H2S=CuS↓+2H+、;操作A中没有FeS和NiS沉淀产生,其原因是(用Ka和Ksp解释)。(3)、操作B加入H2O2的目的是 , 加NaOH溶液调节pH应在范围内;操作C中加入NaF的目的是。(4)、该工艺流程中使用H2S气体,优点是可以制取副产品CuSO4·5H2O,但也有明显的缺点:一是产生空气污染,二是。(5)、电解产生2NiOOH·H2O的原理为:在碱性条件下电解,Cl-在阳极被氧化为ClO- , ClO-再将Ni2+氧化成2NiOOH·H2O沉淀。则阳极的电极反应式为。(6)、0.80g CuSO4·5H2O副产品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如图所示,CuSO4·5H2O稳定存在的温度应低于 , 则200℃时固体物质的化学式。
三、填空题
-
10. 合成氨在工业生产中具有重要意义。(1)、在合成氨工业中I2O5常用于定量测定CO的含量。已知2I2(s)+5O2(g)=2I2O5(s) △H=-76kJ·mol-1;2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1。则该测定反应的热化学方程式为。(2)、不同温度下,向装有足量I2O5固体的2L恒容密闭容器中通入4 mol CO,测得CO2的体积分数φ(CO2)随时间t变化曲线如图。

①温度T1时,0~0.5 min内的反应速率v(CO)=。
②b点CO的平衡转化率α为 , c点的平衡常数K为。
③下列措施能提高该反应CO转化率的是(填字母)
a.升高温度
b.增大压强
c.加入催化剂
d.移走CO2
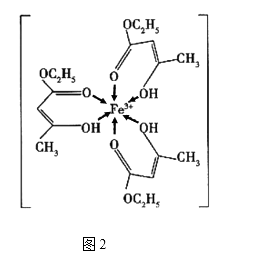
(3)、若氨水与SO2恰好生成正盐,则此时溶液呈(填“酸性”或“碱性”),向上述溶液中通入(填“NH3”或“SO2”)可使溶液呈中性,此时溶液中含硫微粒浓度的大小关系为。(已知常温下NH3·H2O的Kb=1.8×10-5mol·L-1 , H2SO3的Ka1=1.5×10-2mol·L-1 , Ka2=6.3×10-8mol·L-1)11. 金属铁、铜及其化合物在科学研究和工业生产中具有重要的用途。下图1表示铜与氯形成化合物A的晶胞(黑球代表铜原子)。图2是Fe3+与乙酰乙酸乙酯形成的配离子B。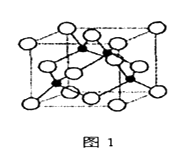
回答下列问题
(1)、基态Cu原子的核外电子排布式为。(2)、从原子结构角度分析,第一电离能I1(Fe)与I1(Cu)的关系是:I1(Fe)I1(Cu)(填“>“<”或“=”)(3)、化合物A的化学式为 , Cl原子的配位数是。(4)、B中碳原子的杂化轨道类型为 , 含有的化学键为(填字母)。a.离子键 b.金属键 c.极性键 d.非极性键 e.配位键 f.氢键 g.σ键 h.π键
(5)、化合物A难溶于水,但易溶于氨水,其原因可能是;与NH3互为等电子体的分子有(写化学式,一种即可)。NH3的键角大于H2O的键角的主要原因是。(6)、已知化合物A晶体的密度为ρg·cm-3 , 阿伏加德罗常数的值为NA , 则该晶体中两个Cu原子之间的最短距离为nm(列出计算表达式即可)。四、推断题
-
12. 合成H的两条途径如图:


回到下列问题:
(1)、关于H说法正确的是(填标号)。a.能使溴水褪色
b.1mol该物质最多能与3mol NaOH反应
c.属于芳香烃类物质
d.分子内最多有9个碳原子共平面
(2)、C生成D的反应类型为 , G的名称为。(3)、写出D生成E的化学方程式。(4)、已知物质M与D互为同分异构体,M的水溶液呈酸性,在一定条件下2molM能生成1mol分子中含六元环结构的有机物,则M在铜的催化下与氧气反应的化学方程式为。(5)、满足下列所有条件的F(结构简式见已知)的同分异构体的数目有种。a.能发生银镜反应
b.苯环上有两个取代基
写出上述异构体中能使FeCl3溶液显紫色,核磁共振氢谱有五组峰且面积比为1:2:2:2:1的结构简式。
(6)、结合已有知识和信息并参照上述合成路线,以丙醇为起始原料(无机试剂任选),设计制备 的合成路线。
的合成路线。