辽宁省葫芦岛市2017-2018学年高考理综-化学二模考试试卷
试卷更新日期:2018-06-13 类型:高考模拟
一、单选题
-
1. 化学与生产,生活密切相关下列有关说法中错误的是( )A、使用含钙离子浓度较大的地下水洗衣服,肥皂去污能力减弱 B、PM2.5是指大气中直径接近2.5×10-6m的颗粒物,其分散在空气中形成胶体 C、“青蒿一握,以水二升渍,绞取汁”,该过程属于物理变化 D、“煤改气”,“煤改电”等清洁燃料改造工程有利于减少雾霾天气2. 对分别盛有不同无色溶液①②③④四支试管进行如下操作。现象和结论对应正确的是( )
操作
现象
结论
A
向①中滴加NaOH溶液,加热,将湿润红色石蕊试纸置于试管口
试纸变蓝
原溶液中有NH4+
B
向②中滴入NaHCO3溶液
有白色沉淀生成
原溶液中有AlO2-
C
向③中先滴加BaCl2溶液再滴加HCl溶液
生成白色沉淀
原溶液中有SO42-
D
向④中滴加氯水和CCl4 , 振荡静置
下层溶液呈橙色
原溶液中有I-
A、A B、B C、C D、D3. 工业上合成乙苯的反应为 ,下列说法错误的是( ) A、乙、丙均可以使酸性高锰酸钾溶液褪色 B、该反应属于加成反应 C、甲、乙均可通过石油分馏获取 D、丙的一氯代物有5种4. 四种短周期元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法错误的是( )A、气态氢化物的稳定性Y<Z B、W与X形成的化合物中只存在离子键 C、W的氢化物分子之间都能形成氢键 D、W、X、Y三种元素组成的化合物的水溶液不一定呈中性5. 新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。下列说法正确的是( )
,下列说法错误的是( ) A、乙、丙均可以使酸性高锰酸钾溶液褪色 B、该反应属于加成反应 C、甲、乙均可通过石油分馏获取 D、丙的一氯代物有5种4. 四种短周期元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法错误的是( )A、气态氢化物的稳定性Y<Z B、W与X形成的化合物中只存在离子键 C、W的氢化物分子之间都能形成氢键 D、W、X、Y三种元素组成的化合物的水溶液不一定呈中性5. 新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。下列说法正确的是( )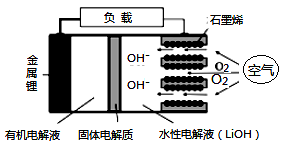 A、Li+穿过固体电解质向正极移动而得到LiOH溶液 B、放电时,当外电路中有1mole-转移时,水性电解液离子总数增加NA C、应用该电池电镀铜,阴极质量增加64g,理论上将消耗11.2LO2 D、放电时,负极反应式:Li-e-+OH-=LiOH6. 一定条件下,在水溶液中1molCl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( )
A、Li+穿过固体电解质向正极移动而得到LiOH溶液 B、放电时,当外电路中有1mole-转移时,水性电解液离子总数增加NA C、应用该电池电镀铜,阴极质量增加64g,理论上将消耗11.2LO2 D、放电时,负极反应式:Li-e-+OH-=LiOH6. 一定条件下,在水溶液中1molCl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是( )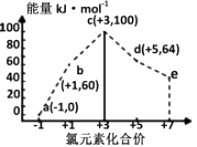 A、a、b、c、d、e中,c最稳定 B、b→a+c反应的活化能为反应物能量减生成物能量 C、b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116kJ·mol-1 D、一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶27. 浓度均为0.1mol/L体积均为Vo的HX、HY溶液,分别加水稀释至体积V,pH随V的变化关系如下图所示。下列叙述错误的是( )
A、a、b、c、d、e中,c最稳定 B、b→a+c反应的活化能为反应物能量减生成物能量 C、b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116kJ·mol-1 D、一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶27. 浓度均为0.1mol/L体积均为Vo的HX、HY溶液,分别加水稀释至体积V,pH随V的变化关系如下图所示。下列叙述错误的是( ) A、HX的酸性比HY的弱,且HY是强酸 B、NaX溶液中存在关系:c(X-)+c(HX)=c(Na+) C、相同温度下,电离常数K(HX):a=b D、 ,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则 减小
A、HX的酸性比HY的弱,且HY是强酸 B、NaX溶液中存在关系:c(X-)+c(HX)=c(Na+) C、相同温度下,电离常数K(HX):a=b D、 ,若同时微热两种溶液(不考虑HX、HY和H2O的挥发),则 减小二、综合题
-
8. 利用酸解法制钛白粉产生的废液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4]生产铁红和补血剂乳酸亚铁。其生产步骤如下:

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42- , TiOSO4水解成TiO2·xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OHCOOH.请回答:
(1)、步骤①中分离硫酸重铁溶液和滤渣的操作是。(2)、加入铁屑的目一是还原少量Fe2(SO4)3;二是使少量TiOSO4转化为TiO2·xH2O滤渣,用平衡移动的原理解释得到滤渣的原因。(3)、硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为。(4)、用离子方程式解释步骤⑤中加乳酸能得到乳酸亚铁的原因。(5)、步骤④的离子方程式是。(6)、步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及。(7)、乳酸亚佚晶体{[CH3CH(OH)COO]2Fe·3H2O}纯度的测量:若用KMnO4滴定法测定样品中Fe的量进而计算纯度时,发现结果总是大于100%,其原因可能是。经查阅文献后,改用Ce(SO4)2标准溶液滴定进行测定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760g样品,溶解后进行必要处理,用容量瓶配制成250mL溶液,每次取25.00mL,用0.1000mol/LCe(SO4)2标准溶液滴定至终点记录数据如下表。
滴定次数
0.1000mol/LCe(SO4)2标准溶液/Ml
滴定前读数
滴定后读数
1
0.10
19.85
2
0.12
21.32
3
1.05
20.70
4
0.16
19.88
则产品中乳酸亚铁晶体的纯度为(以质量分数表示)。
9. 碳的氧化物和氮的氧化物与人类生活息息相关,它们之间有多种相互转化关系,可以变废为宝。(1)、为了模拟汽车尾气在催化转化器内的工作反应情况,控制定条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g),用传感器测得不同时间NO和CO的依度如下表:时间/s
0
1
2
3
4
5
c(NO)(10-4mol/L)
10.0
4.50
2.50
1.50
1.00
1.00
c(NO)(10-3mol/L)
3.60
3.05
2.85
2.75
2.70
2.70
①前2s内的平均反应速率v(N2)= , 此温度下,该反应的平衡常数K=
②能说明上述反应达到平衡状态的是。
A.2n(CO2)=n(N2)
B.混合气体的平均相对分子质量不变
C.气体密度不变
D.容器内气体压强不变
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示。则NO的平衡转化率随温度升高而减小的原因是 ,压强p1、P2、P3的大小关系是 , 理由是。
 (2)、用氨气催化氧化还原法脱硝(NOx)
(2)、用氨气催化氧化还原法脱硝(NOx)①根据下图判断提高脱硝效率(单位时间内NOx浓度变化占烟气初始浓度的百分比)的最佳条件是:。

②已知:N2(g)+O2(g)=2NO(g)△H=+akJ/mol
N2(g)+3H2(g) 2NH3(g)△H=-bk/mol
2H2(g)+O2(g)=2H2O(g)△H=-ckJ/mol其中a、b、c均为大于0。
则放热反应:4NO(g)+4NH3(g)+O2(g) 4N2(g)+6H2O(g)△H=。
10. 由B、N及Mg、Ni等元素组成的新型材料有着广泛的用途,回答下列向题:(1)、Ni2+元素基态原子的电子排布式为。(2)、经测定发现,N2O5固体由NO2+和NO3-同种离子组成,该固体中N原子杂化类型为;与NO2+互为等电子体的微粒有(写出一种)。(3)、铵盐大多不稳定。NH4F、NH4I中,较易分解的是 , 原因是。(4)、第二周期中,第一电离能介于B元素和N元素间的元素为(填元素符号)(5)、已知NiO的晶体结构如图所示。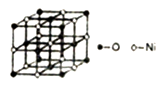
①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO晶体中镍原子填充在氧原子形成的体空隙中。
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm,则熔点MgONiO(填“>”、“<”或“=”),理由是。
(6)、硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似B、N原子相互交替排列如图左下图,其晶胞结构如右下图所示。设层内B-N核间距为apm,面间距为bpm,则该氮化硼晶体的密度为g/cm3(用含a、b、NA的代数式表示)。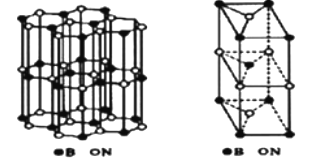 11. 由烃A制备抗结肠炎药物H的一种合成路线如下(部分反应略去试剂和条件):
11. 由烃A制备抗结肠炎药物H的一种合成路线如下(部分反应略去试剂和条件):
已知:I.

II.

回答下列问题:
(1)、反应②的类型是。(2)、D的结构简式是。(3)、G中含有的官能团的名称是。(4)、E与足量NaOH溶液反应的化学方程式是。(5)、设计C→D和E→F两步反应的共同目的是。(6)、化合物X是H的同分异构体,X遇FeCl3溶液不发生显色反应,其核磁共振氢谱显示有3种不同化学环境的氢。峰面积比为3:2:2,写出1种符合要求的X的结构简式。(7)、已知 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位。据此写出以A为原料制备化合物  的合成路线(其他试剂任选)。
的合成路线(其他试剂任选)。 三、实验题
-
12. 研究小组进行右图所示实验,试剂A为0.2mol/LCuSO4溶液,发现铝条表面无明显变化,于是改变实验条件,探究铝和CuSO4溶液、CuCl2溶液反应的影响因素。用不同的试剂A进行实验1~实验4,并记录实验现象:

实验序号
试剂A
实验现象
1
0.2mol/LCuCl2溶液
铝条表面有气泡产生,并有红色固体析出
2
0.2mol/LCuSO4溶液,再加入一定质量的NaCl固体
开始铝条表面无明显变化,加NaCl后,铝条表面有气泡产生,并有红色固体析出
3
2mol/LCuSO4溶液
铝条表面有少量气泡产生,并有少量红色固体
4
2mol/LCuCl2溶液
反应非常剧烈,有大量气泡产生,溶液变成棕褐色,有红色固体和白色固体生成
(1)、实验1中,铝条表面析出红色固体的反应的离子方程式为。(2)、实验2的目的是证明铜盐中的阴离子Cl-是导致实验1中反应迅速发生的原因,实验2中加入NaCl固体的质量为g。(3)、实验3的目的是。(4)、经检验可知,实验4中白色固体为CuCl。甲同学认为产生白色固体的原因可能是发生了Cu+CuCl2=2CuCl的反应,他设计了右图所示实验证明该反应能够发生。
①A极的电极材料是。
②能证明该反应发生的实验现象是。
(5)、为探究实验4中溶液呈现棕褐色的原因,分别取白色CuCl固体进行以下实验:实验序号
实验操作
实验现象
i
加入浓NaCl溶液
沉淀溶解,形成无色溶液
ii
加入饱和AlCl3溶液
沉淀溶解,形成褐色溶液
iii
向i所得溶液中加入2mol/LCuCl2溶液
溶液由无色变为褐色
查阅资料知:CuCl难溶于水,能溶解在Cl-浓度较大的溶液中,生成[CuCl2]-络离子,用水稀释含[CuCl2]-的溶液时会重新析出CuCl沉淀。
①由述球实验及资料可推断,实验4中溶液呈棕褐色的原因可能是[CuCl2]-与作用的结果。
②为确证实验4所得的棕褐色溶液中含有[CuCl2]- , 应补充的实验是。
(6)、上述实验说明,铝和CuSO4溶液、CuCl2溶液的反应现象与有关。