2018年高考化学真题试卷(江苏卷)
试卷更新日期:2018-06-13 类型:高考真卷
一、单项选择题
-
1. CO2是自然界碳循环中的重要物质。下列过程会引起大气中CO2含量上升的是( )A、光合作用 B、自然降雨 C、化石燃料的燃烧 D、碳酸盐的沉积2. 用化学用语表示 NH3+ HCl=NH4Cl中的相关微粒,其中正确的是( )A、中子数为8 的氮原子: B、HCl 的电子式:
 C、NH3的结构式:
C、NH3的结构式: 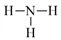 D、Cl−的结构示意图:
D、Cl−的结构示意图: 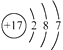 3. 下列有关物质性质与用途具有对应关系的是( )A、NaHCO3受热易分解,可用于制胃酸中和剂 B、SiO2熔点高硬度大,可用于制光导纤维 C、Al2O3是两性氧化物,可用作耐高温材料 D、CaO能与水反应,可用作食品干燥剂4. 室温下,下列各组离子在指定溶液中能大量共存的是( )A、0. 1 mol·L−1KI 溶液:Na+、K+、ClO− 、OH− B、0. 1 mol·L−1Fe2(SO4)3溶液:Cu2+、NH4+、NO3−、SO42− C、0. 1 mol·L−1HCl 溶液:Ba2+、K+、CH3COO−、NO3− D、0. 1 mol·L−1NaOH溶液:Mg2+、Na+、SO42−、HCO3−5. 下列有关从海带中提取碘的实验原理和装置能达到实验目的的是( )
3. 下列有关物质性质与用途具有对应关系的是( )A、NaHCO3受热易分解,可用于制胃酸中和剂 B、SiO2熔点高硬度大,可用于制光导纤维 C、Al2O3是两性氧化物,可用作耐高温材料 D、CaO能与水反应,可用作食品干燥剂4. 室温下,下列各组离子在指定溶液中能大量共存的是( )A、0. 1 mol·L−1KI 溶液:Na+、K+、ClO− 、OH− B、0. 1 mol·L−1Fe2(SO4)3溶液:Cu2+、NH4+、NO3−、SO42− C、0. 1 mol·L−1HCl 溶液:Ba2+、K+、CH3COO−、NO3− D、0. 1 mol·L−1NaOH溶液:Mg2+、Na+、SO42−、HCO3−5. 下列有关从海带中提取碘的实验原理和装置能达到实验目的的是( ) A、用装置甲灼烧碎海带 B、用装置乙过滤海带灰的浸泡液 C、用装置丙制备用于氧化浸泡液中I−的Cl2 D、用装置丁吸收氧化浸泡液中I−后的Cl2尾气6. 下列有关物质性质的叙述一定错误的是( )A、向FeCl2溶液中滴加NH4SCN溶液,溶液显红色 B、KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体 C、NH4Cl与Ca(OH)2混合加热可生成NH3 D、Cu与FeCl3溶液反应可生成CuCl27. 下列指定反应的离子方程式正确的是( )A、饱和Na2CO3溶液与CaSO4固体反应:CO32−+CaSO4 CaCO3+SO42− B、酸化NaIO3和NaI的混合溶液:I− +IO3−+6H+=I2+3H2O C、KClO碱性溶液与Fe(OH)3反应:3ClO−+2Fe(OH)3=2FeO42−+3Cl−+4H++H2O D、电解饱和食盐水:2Cl−+2H+ Cl2↑+ H2↑8. 短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是( )A、原子半径:r(W) > r(Z) > r(Y) B、由X、Y 组成的化合物中均不含共价键 C、Y 的最高价氧化物的水化物的碱性比Z的弱 D、X 的简单气态氢化物的热稳定性比W的强9. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、10. 下列说法正确的是( )A、氢氧燃料电池放电时化学能全部转化为电能 B、反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应为吸热反应 C、3 mol H2与1 mol N2混合反应生成NH3 , 转移电子的数目小于6×6.02×1023 D、在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
A、用装置甲灼烧碎海带 B、用装置乙过滤海带灰的浸泡液 C、用装置丙制备用于氧化浸泡液中I−的Cl2 D、用装置丁吸收氧化浸泡液中I−后的Cl2尾气6. 下列有关物质性质的叙述一定错误的是( )A、向FeCl2溶液中滴加NH4SCN溶液,溶液显红色 B、KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体 C、NH4Cl与Ca(OH)2混合加热可生成NH3 D、Cu与FeCl3溶液反应可生成CuCl27. 下列指定反应的离子方程式正确的是( )A、饱和Na2CO3溶液与CaSO4固体反应:CO32−+CaSO4 CaCO3+SO42− B、酸化NaIO3和NaI的混合溶液:I− +IO3−+6H+=I2+3H2O C、KClO碱性溶液与Fe(OH)3反应:3ClO−+2Fe(OH)3=2FeO42−+3Cl−+4H++H2O D、电解饱和食盐水:2Cl−+2H+ Cl2↑+ H2↑8. 短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是( )A、原子半径:r(W) > r(Z) > r(Y) B、由X、Y 组成的化合物中均不含共价键 C、Y 的最高价氧化物的水化物的碱性比Z的弱 D、X 的简单气态氢化物的热稳定性比W的强9. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、 B、 C、 D、10. 下列说法正确的是( )A、氢氧燃料电池放电时化学能全部转化为电能 B、反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应为吸热反应 C、3 mol H2与1 mol N2混合反应生成NH3 , 转移电子的数目小于6×6.02×1023 D、在酶催化淀粉水解反应中,温度越高淀粉水解速率越快二、不定项选择题
-
11. 化合物Y 能用于高性能光学树脂的合成,可由化合物X与2 −甲基丙烯酰氯在一定条件下反应制得:
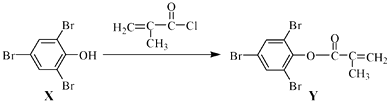
下列有关化合物X、Y 的说法正确的是( )
A、X 分子中所有原子一定在同一平面上 B、Y与Br2的加成产物分子中含有手性碳原子 C、X、Y均不能使酸性KMnO4溶液褪色 D、X→Y的反应为取代反应12. 根据下列实验操作和现象所得出的结论正确的是( )选项
实验操作和现象
结论
A
向苯酚浊液中滴加Na2CO3溶液,浊液变清
苯酚的酸性强于H2CO3的酸性
B
向碘水中加入等体积CCl4 , 振荡后静置,上层接近无色,下层显紫红色
I2在CCl4中的溶解度大于在水中的溶解度
C
向CuSO4溶液中加入铁粉,有红色固体析出
Fe2+的氧化性强于Cu2+的氧化性
D
向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成
Ksp(AgCl) >Ksp(AgI)
A、A B、B C、C D、D13. 根据下列图示所得出的结论错误的是( )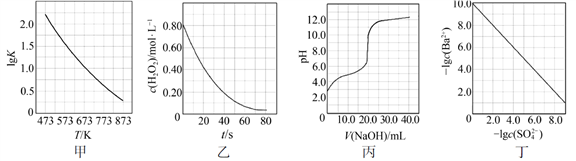 A、图甲是CO(g)+H2O(g)=CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0 B、图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小 C、图丙是室温下用0.1000 mol·L−1NaOH溶液滴定20.00 mL 0.1000 mol·L−1某一元酸HX的滴定曲线,说明HX是一元强酸 D、图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42−)的关系曲线,说明溶液中c(SO42− )越大c(Ba2+ )越小14. H2C2O4为二元弱酸,Ka1 (H2C2O4 ) =5.4×10−2 , Ka2 (H2C2O4 ) =5.4×10−5 , 设H2C2O4溶液中c(总)=c(H2C2O4) +c(HC2O4−) +c(C2O42−)。室温下用NaOH溶液滴定25.00 mL 0.1000 mol·L−1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )A、0.1000 mol·L−1 H2C2O4溶液:c(H+ ) =0.1000 mol·L−1+c(C2O42− )+c(OH−)−c(H2C2O4 ) B、c(Na+ ) =c(总)的溶液:c(Na+ ) >c(H2C2O4 ) >c(C2O42− ) >c(H+ ) C、pH = 7的溶液:c(Na+ ) =0.1000 mol·L−1+ c(C2O42−) −c(H2C2O4) D、c(Na+ ) =2c(总)的溶液:c(OH−) −c(H+) = 2c(H2C2O4) +c(HC2O4−)15. 一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) 2SO3(g)(正反应放热),测得反应的相关数据如下:
A、图甲是CO(g)+H2O(g)=CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0 B、图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小 C、图丙是室温下用0.1000 mol·L−1NaOH溶液滴定20.00 mL 0.1000 mol·L−1某一元酸HX的滴定曲线,说明HX是一元强酸 D、图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42−)的关系曲线,说明溶液中c(SO42− )越大c(Ba2+ )越小14. H2C2O4为二元弱酸,Ka1 (H2C2O4 ) =5.4×10−2 , Ka2 (H2C2O4 ) =5.4×10−5 , 设H2C2O4溶液中c(总)=c(H2C2O4) +c(HC2O4−) +c(C2O42−)。室温下用NaOH溶液滴定25.00 mL 0.1000 mol·L−1H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )A、0.1000 mol·L−1 H2C2O4溶液:c(H+ ) =0.1000 mol·L−1+c(C2O42− )+c(OH−)−c(H2C2O4 ) B、c(Na+ ) =c(总)的溶液:c(Na+ ) >c(H2C2O4 ) >c(C2O42− ) >c(H+ ) C、pH = 7的溶液:c(Na+ ) =0.1000 mol·L−1+ c(C2O42−) −c(H2C2O4) D、c(Na+ ) =2c(总)的溶液:c(OH−) −c(H+) = 2c(H2C2O4) +c(HC2O4−)15. 一定温度下,在三个容积相同的恒容密闭容器中按不同方式投入反应物,发生反应2SO2(g)+ O2(g) 2SO3(g)(正反应放热),测得反应的相关数据如下: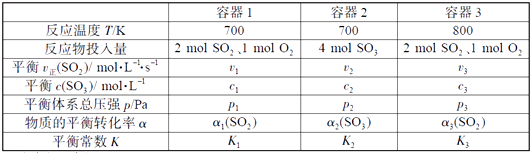
下列说法正确的是( )
A、v1< v2 , c2< 2c1 B、K1> K3 , p2> 2p3 C、v1< v3 , α1(SO2 ) >α3(SO2 ) D、c2> 2c3 , α2(SO3 )+α3(SO2 )<1三、非选择题
-
16. 以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2 , 少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:
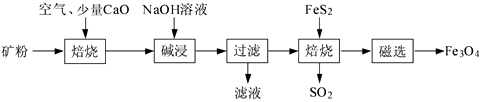 (1)、焙烧过程均会产生SO2 , 用NaOH溶液吸收过量SO2的离子方程式为。(2)、添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。
(1)、焙烧过程均会产生SO2 , 用NaOH溶液吸收过量SO2的离子方程式为。(2)、添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。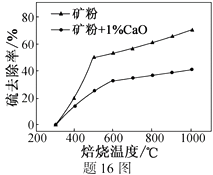
已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1— )×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是。
(3)、向“过滤”得到的滤液中通入过量CO2 , 铝元素存在的形式由(填化学式)转化为(填化学式)。(4)、“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2 , 理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=。17. 丹参醇是存在于中药丹参中的一种天然产物。合成丹参醇的部分路线如下: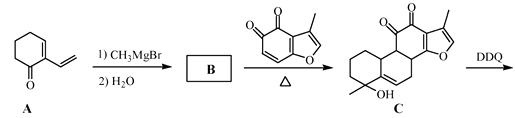
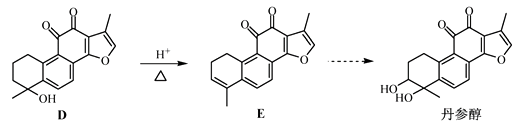
已知:
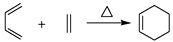 (1)、A中的官能团名称为(写两种)。(2)、D E的反应类型为。(3)、B的分子式为C9H14O,写出B的结构简式:。(4)、
(1)、A中的官能团名称为(写两种)。(2)、D E的反应类型为。(3)、B的分子式为C9H14O,写出B的结构简式:。(4)、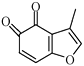 的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。
的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:。①分子中含有苯环,能与FeCl3溶液发生显色反应,不能发生银镜反应;
②碱性条件水解生成两种产物,酸化后分子中均只有2种不同化学环境的氢。
(5)、写出以 和
和 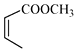 为原料制备
为原料制备  的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。 18. 碱式硫酸铝溶液可用于烟气脱硫。室温下向一定浓度的硫酸铝溶液中加入一定量的碳酸钙粉末,反应后经过滤得到碱式硫酸铝溶液,反应方程式为
的合成路线流程图(无机试剂和乙醇任用,合成路线流程图示例见本题题干)。 18. 碱式硫酸铝溶液可用于烟气脱硫。室温下向一定浓度的硫酸铝溶液中加入一定量的碳酸钙粉末,反应后经过滤得到碱式硫酸铝溶液,反应方程式为(2−x)Al2(SO4)3+3xCaCO3+3xH2O=2[(1−x)Al2(SO4)3·xAl(OH)3]+3xCaSO4↓+3xCO2↑
生成物(1−x)Al2(SO4)3·xAl(OH)3中x值的大小影响碱式硫酸铝溶液的脱硫效率。
(1)、制备碱式硫酸铝溶液时,维持反应温度和反应时间不变,提高x值的方法有。(2)、碱式硫酸铝溶液吸收SO2过程中,溶液的pH(填“增大”、“减小”、“不变”)。(3)、通过测定碱式硫酸铝溶液中相关离子的浓度确定x的值,测定方法如下:①取碱式硫酸铝溶液25.00 mL,加入盐酸酸化的过量BaCl2溶液充分反应,静置后过滤、洗涤,干燥至恒重,得固体2.3300 g。
②取碱式硫酸铝溶液2.50 mL,稀释至25 mL,加入0.1000 mol·L−1EDTA标准溶液25.00 mL,调节溶液pH约为4.2,煮沸,冷却后用0.08000 mol·L−1CuSO4标准溶液滴定过量的EDTA至终点,消耗CuSO4标准溶液20.00 mL(已知Al3+、Cu2+与EDTA反应的化学计量比均为1∶1)。
计算(1−x)Al2(SO4)3·xAl(OH)3中的x值(写出计算过程)。
19. 以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3 , 其主要实验流程如下:
已知:①Cl2+2OH−=ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(1)、步骤Ⅰ制备NaClO溶液时,若温度超过40 ℃,Cl2与NaOH溶液反应生成NaClO3和NaCl,其离子方程式为;实验中控制温度除用冰水浴外,还需采取的措施是。(2)、步骤Ⅱ合成N2H4·H2O的装置如题19图−1所示。NaClO碱性溶液与尿素水溶液在40 ℃以下反应一段时间后,再迅速升温至110 ℃继续反应。实验中通过滴液漏斗滴加的溶液是;使用冷凝管的目的是。 (3)、步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、 、 随pH的分布如题19图−2所示,Na2SO3的溶解度曲线如题19图−3所示)。
(3)、步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、 、 随pH的分布如题19图−2所示,Na2SO3的溶解度曲线如题19图−3所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。实验中确定何时停止通SO2的实验操作为。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: , 用少量无水乙醇洗涤,干燥,密封包装。
20. NOx(主要指NO和NO2)是大气主要污染物之一。有效去除大气中的NOx是环境保护的重要课题。(1)、用水吸收NOx的相关热化学方程式如下:2NO2(g)+H2O(l)=HNO3(aq)+HNO2(aq) ΔH=−116.1 kJ·mol−1
3HNO2(aq)=HNO3(aq)+2NO(g)+H2O(l) ΔH=75.9 kJ·mol−1
反应3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)的ΔH=kJ·mol−1。
(2)、用稀硝酸吸收NOx , 得到HNO3和HNO2的混合溶液,电解该混合溶液可获得较浓的硝酸。写出电解时阳极的电极反应式:。(3)、用酸性(NH2)2CO水溶液吸收NOx , 吸收过程中存在HNO2与(NH2)2CO生成N2和CO2的反应。写出该反应的化学方程式:。(4)、在有氧条件下,新型催化剂M能催化NH3与NOx反应生成N2。①NH3与NO2生成N2的反应中,当生成1 mol N2时,转移的电子数为mol。
②将一定比例的O2、NH3和NOx的混合气体,匀速通入装有催化剂M的反应器中反应(装置见题20图−1)。
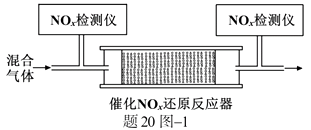
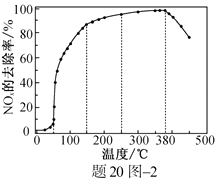
反应相同时间NOx的去除率随反应温度的变化曲线如题20图−2所示,在50~250 ℃范围内随着温度的升高,NOx的去除率先迅速上升后上升缓慢的主要原因是;当反应温度高于380 ℃时,NOx的去除率迅速下降的原因可能是。
四、选做题A.[物质结构与性质]
-
21. 臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为 和 ,NOx也可在其他条件下被还原为N2。(1)、 中心原子轨道的杂化类型为; 的空间构型为(用文字描述)。(2)、Fe2+基态核外电子排布式为。(3)、与O3分子互为等电子体的一种阴离子为(填化学式)。(4)、N2分子中σ键与π键的数目比n(σ)∶n(π)=。(5)、[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。

五、选做题B.[实验化学]
-
22. 3,4−亚甲二氧基苯甲酸是一种用途广泛的有机合成中间体,微溶于水,实验室可用KMnO4氧化3,4−亚甲二氧基苯甲醛制备,其反应方程式为

实验步骤如下:
步骤1:向反应瓶中加入3,4−亚甲二氧基苯甲醛和水,快速搅拌,于70~80 ℃滴加KMnO4溶液。反应结束后,加入KOH溶液至碱性。
步骤2:趁热过滤,洗涤滤饼,合并滤液和洗涤液。
步骤3:对合并后的溶液进行处理。
步骤4:抽滤,洗涤,干燥,得3,4−亚甲二氧基苯甲酸固体。
(1)、步骤1中,反应结束后,若观察到反应液呈紫红色,需向溶液中滴加NaHSO3溶液, 转化为(填化学式);加入KOH溶液至碱性的目的是。(2)、步骤2中,趁热过滤除去的物质是(填化学式)。(3)、步骤3中,处理合并后溶液的实验操作为。(4)、步骤4中,抽滤所用的装置包括、吸滤瓶、安全瓶和抽气泵。
-