江苏省南通市2017-2018学年高考理综-化学三模考试试卷
试卷更新日期:2018-06-13 类型:高考模拟
一、单选题
-
1. 党的十九大强调要牢固树立“社会主义生态文明观”。下列做法不应该提倡的是( )A、推进垃圾分类处理,充分利用可回收资源 B、工业污水远海排放,降低对生活环境的影响 C、研发新能源汽车,减少化石燃料的使用 D、发展生态农业,减少农药对自然的伤害2. 下列有关化学用语表示正确的是( )A、S2-结构示意图:
 B、HClO的电子式:
B、HClO的电子式: 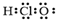 C、丙醛的结构简式:CH3CH2COH
D、中子数为10的氟原子:109F
3. 下列有关物质性质与用途具有对应关系的是( )A、铝具有延展性,可用于冶炼金属 B、木炭具有还原性,可用于冰箱除异味 C、过氧化钠呈浅黄色,可用于潜水艇供氧 D、碳酸钠水解呈碱性,可用于清洗油污4. 下列有关硫酸的实验装置和原理能达到实验目的的是( )A、配制100mL 0.100mol/L硫酸
C、丙醛的结构简式:CH3CH2COH
D、中子数为10的氟原子:109F
3. 下列有关物质性质与用途具有对应关系的是( )A、铝具有延展性,可用于冶炼金属 B、木炭具有还原性,可用于冰箱除异味 C、过氧化钠呈浅黄色,可用于潜水艇供氧 D、碳酸钠水解呈碱性,可用于清洗油污4. 下列有关硫酸的实验装置和原理能达到实验目的的是( )A、配制100mL 0.100mol/L硫酸 B、干燥氨气
B、干燥氨气  C、分离稀硫酸与硝基苯的混合物
C、分离稀硫酸与硝基苯的混合物  D、制取并收集SO2
D、制取并收集SO2 5. 下列指定反应的离子方程式正确的是( )A、电解熔融NaCl:2Cl-+2H2O 2OH-+Cl2↑+H2↑ B、用氨水溶解AgCl沉淀:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O C、Na2CO3溶液吸收溴蒸气:3CO32-+Br2=Br-+BrO3-+3CO2 D、金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑6. 短周期主族元素X、Y、Z、W、Q原子序数依次增大,其中X是组成有机物的必要元素,元素Y的原子最外层电子数是其电子层数的3倍,元素W与X同主族,Z与Q最外层电子数相差6。下列说法正确的是( )A、原子半径:r(Q)>r(W)>r(X)>r(Y) B、W的简单气态氢化物的热稳定性比X的强 C、Y与Z可形成含共价键的离子化合物 D、元素Y、Z、Q组成的化合物水溶液一定呈碱性7. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、NaClO(aq) HClO(aq) HCl(aq) B、H2SiO3 SiO2 SiCl4 C、Al Al(OH)3 Al2O3 D、Fe2O3 Fe(OH)3 Fe2(SO4)3(aq)8. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、无色透明的溶液中:Fe3+、NH
5. 下列指定反应的离子方程式正确的是( )A、电解熔融NaCl:2Cl-+2H2O 2OH-+Cl2↑+H2↑ B、用氨水溶解AgCl沉淀:Ag++2NH3·H2O=[Ag(NH3)2]++2H2O C、Na2CO3溶液吸收溴蒸气:3CO32-+Br2=Br-+BrO3-+3CO2 D、金属钠与水反应:2Na+2H2O=2Na++2OH-+H2↑6. 短周期主族元素X、Y、Z、W、Q原子序数依次增大,其中X是组成有机物的必要元素,元素Y的原子最外层电子数是其电子层数的3倍,元素W与X同主族,Z与Q最外层电子数相差6。下列说法正确的是( )A、原子半径:r(Q)>r(W)>r(X)>r(Y) B、W的简单气态氢化物的热稳定性比X的强 C、Y与Z可形成含共价键的离子化合物 D、元素Y、Z、Q组成的化合物水溶液一定呈碱性7. 在给定条件下,下列选项所示的物质间转化均能实现的是( )A、NaClO(aq) HClO(aq) HCl(aq) B、H2SiO3 SiO2 SiCl4 C、Al Al(OH)3 Al2O3 D、Fe2O3 Fe(OH)3 Fe2(SO4)3(aq)8. 常温下,下列各组离子在指定溶液中能大量共存的是( )A、无色透明的溶液中:Fe3+、NH 、I-、CO
、I-、CO 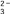 B、0.1 mol·L-1 KNO3溶液中:Na+、Fe2+、Cl-、SO
B、0.1 mol·L-1 KNO3溶液中:Na+、Fe2+、Cl-、SO  C、使甲基橙变红的溶液中:Na+、Mg2+、SO
C、使甲基橙变红的溶液中:Na+、Mg2+、SO 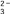 、AlO2-
D、水电离产生的c(H+) =10-13mol·L-1的溶液中:K+、Ca2+、NO
、AlO2-
D、水电离产生的c(H+) =10-13mol·L-1的溶液中:K+、Ca2+、NO  、HCO
、HCO  9. 反应“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g) ΔH>0”制得的NaH2PO2可用于化学镀镍。下列说法正确的是( )
9. 反应“P4(s)+3NaOH(aq)+3H2O(l)=3NaH2PO2(aq)+PH3(g) ΔH>0”制得的NaH2PO2可用于化学镀镍。下列说法正确的是( )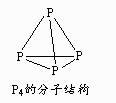 A、P4分子中P原子均满足8电子稳定结构 B、反应中NaOH作还原剂 C、该反应能自发进行,则ΔS<0 D、反应中生成1 mol NaH2PO2 , 转移电子数目为3×6.02×102310. 向湿法炼锌的电解液中同时加入Cu和CuSO4 , 可生成CuCl沉淀除去Cl— , 降低对电解的影响,反应原理如下:
A、P4分子中P原子均满足8电子稳定结构 B、反应中NaOH作还原剂 C、该反应能自发进行,则ΔS<0 D、反应中生成1 mol NaH2PO2 , 转移电子数目为3×6.02×102310. 向湿法炼锌的电解液中同时加入Cu和CuSO4 , 可生成CuCl沉淀除去Cl— , 降低对电解的影响,反应原理如下:Cu(s)+Cu2+(aq) 2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq) CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。下列说法正确的是( )
 A、溶液pH越大,Ksp(CuCl)增大 B、向电解液中加入稀硫酸,有利于Cl-的去除 C、反应达到平衡增大c(Cu2+),c(Cl-)减小 D、 Cu(s)+ Cu2+(aq)+Cl—(aq) CuCl(s)的ΔH=(a+2b) kJ·mol-111. 某吸水性高分子化合物(Z)的一种合成路线如下:
A、溶液pH越大,Ksp(CuCl)增大 B、向电解液中加入稀硫酸,有利于Cl-的去除 C、反应达到平衡增大c(Cu2+),c(Cl-)减小 D、 Cu(s)+ Cu2+(aq)+Cl—(aq) CuCl(s)的ΔH=(a+2b) kJ·mol-111. 某吸水性高分子化合物(Z)的一种合成路线如下:
下列说法正确的是( )
A、X、Y分子中均有两个手性碳原子 B、过量酸性KMnO4溶液可将X转化为Y C、Y转化为Z的反应类型是加聚反应 D、Z与足量H2发生加成反应,消耗Z与H2的分子数之比为1:312. 根据下列实验操作和现象所得到的结论正确的是( )选项
实验操作
实验现象
结论
A
向蛋白质溶液中滴加CuSO4溶液
有固体析出
蛋白质发生盐析
B
向浓度均为0.10 mol·L-1的KCl和KI混合溶液中滴加少量AgNO3溶液
出现黄色沉淀
Ksp(AgCl)>Ksp(AgI)
C
取等物质的量的Al和Fe,分别与足量的盐酸反应
Al产生的氢气多
金属性:Al>Fe
D
向苯酚浊液中滴加饱和Na2CO3溶液
浊液变澄清
酸性:苯酚>碳酸
A、A B、B C、C D、D二、多选题
-
13. 下列有关说法正确的是( )A、一定条件下反应2SO2+O2 2SO3达到平衡时,v(O2)正=2v(SO3)逆 B、用右图所示方法可保护钢闸门不被腐蚀
 C、常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中 的值增大
D、常温下, pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应
14. 常温下,用0.10 mol·L-1盐酸分别滴定20.00 mL浓度均为0.10 mol·L-1 CH3COONa溶液和NaCN溶液,所得滴定曲线如右图(忽略体积变化)。下列说法正确的是( )
C、常温下,向NH4Cl溶液中加入少量NaOH固体,溶液中 的值增大
D、常温下, pH=2的HCl溶液与pH=12的Ba(OH)2溶液等体积混合,两者恰好完全反应
14. 常温下,用0.10 mol·L-1盐酸分别滴定20.00 mL浓度均为0.10 mol·L-1 CH3COONa溶液和NaCN溶液,所得滴定曲线如右图(忽略体积变化)。下列说法正确的是( )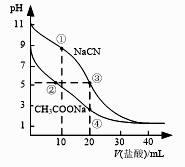 A、溶液中阳离子的物质的量浓度之和:点②等于点③ B、点①所示溶液中:c(CN-)+ c(HCN)=2c(Cl-) C、点②所示溶液中:c(Na+)> c(Cl-)> c(CH3COO-)> c(CH3COOH) D、点④所示溶液中:c(Na+)+ c(CH3COOH)+ c(H+)>0.10 mol·L-115. 在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g) 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是( )
A、溶液中阳离子的物质的量浓度之和:点②等于点③ B、点①所示溶液中:c(CN-)+ c(HCN)=2c(Cl-) C、点②所示溶液中:c(Na+)> c(Cl-)> c(CH3COO-)> c(CH3COOH) D、点④所示溶液中:c(Na+)+ c(CH3COOH)+ c(H+)>0.10 mol·L-115. 在3个体积均为1 L的恒容密闭容器中发生反应:SO2(g)+2NO(g) 2NO2(g)+S(s)。改变容器I的反应温度,平衡时c( NO2)与温度的关系如下图所示。下列说法正确的是( )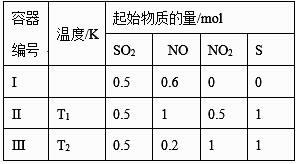
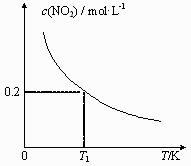 A、该反应的ΔH<0 B、T1时,该反应的平衡常数为 C、容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2 D、若T2<T1 , 达到平衡时,容器Ⅲ中NO的体积分数小于40%
A、该反应的ΔH<0 B、T1时,该反应的平衡常数为 C、容器Ⅰ与容器Ⅱ均在T1时达到平衡,总压强之比小于1:2 D、若T2<T1 , 达到平衡时,容器Ⅲ中NO的体积分数小于40%三、实验题
-
16. 氧化锂(Li2O)是锂电池工业的重要原料。以粗碳酸锂为原料制备氧化锂的一种工艺流程如下:
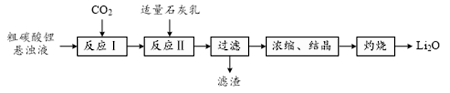
注:常温下,碳酸锂微溶于水,氢氧化锂可溶于水。
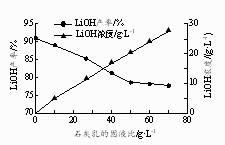
(1)、反应Ⅰ中通入CO2需加压的原因是。(2)、①反应Ⅱ生成LiOH的化学方程式为。②石灰乳的固液比[Ca(OH)2的质量与H2O的体积之比]对LiOH产率和滤液中LiOH浓度的影响如右图所示。实际生产中选择固液比25 g·L-1 , 若固液比过低对后续操作的不利影响是。
 (3)、浓缩、结晶所得LiOH·H2O通过灼烧得到Li2O。
(3)、浓缩、结晶所得LiOH·H2O通过灼烧得到Li2O。①LiOH·H2O中常含有少量的Li2CO3 , 但该物质对所制Li2O得纯度无影响,其原因是。
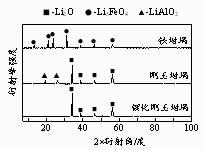
②将LiOH·H2O置于不同坩埚内,在空气中充分灼烧,反应后固体产物的XRD图谱如右图所示(XRD图谱可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。欲制得高纯氧化锂最适宜的坩埚是。铁坩埚中发生反应的化学方程式为。
 17. 某研究小组利用BaS的还原性提纯HBr溶液,并制取溴化镁的方案如下:
17. 某研究小组利用BaS的还原性提纯HBr溶液,并制取溴化镁的方案如下: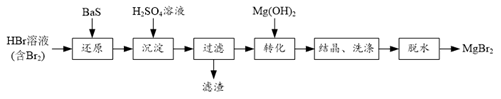 (1)、“还原”步骤中BaS不宜过量太多的原因是。(2)、滤渣的成分是。(3)、结晶获得的MgBr2·6H2O用乙醇洗涤,从洗涤液中回收乙醇的实验方法是。(4)、利用如图装置将MgBr2·6H2O脱水得到MgBr2。
(1)、“还原”步骤中BaS不宜过量太多的原因是。(2)、滤渣的成分是。(3)、结晶获得的MgBr2·6H2O用乙醇洗涤,从洗涤液中回收乙醇的实验方法是。(4)、利用如图装置将MgBr2·6H2O脱水得到MgBr2。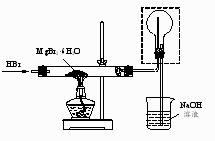
①通入HBr的目的是。
②图中框内装置的作用是。
(5)、已知:BaS+H2O2=Ba(OH)2+S↓。请补充完整实验室由BaS制取高纯BaSO3的实验方案:取BaS加水浸出,边搅拌边在浸出液中加入过量H2O2 , 过滤, , (实验中须使用的试剂有:SO2气体,溶有SO2的水,除常用仪器外须使用的仪器有:真空干燥箱、pH计)。18. 葡萄糖酸亚铁[(C6H11O7)2Fe•2H2O]是重要的矿物质添加剂,它的吸收效果比无机铁盐好。一种工业上制备葡萄糖酸亚铁的工艺流程如下: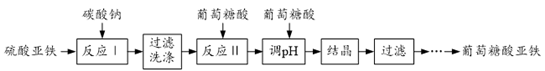 (1)、反应Ⅰ的化学方程式为。(2)、①碳酸亚铁过滤时需在表面保留水层的原因是;
(1)、反应Ⅰ的化学方程式为。(2)、①碳酸亚铁过滤时需在表面保留水层的原因是;②检验FeCO3已经洗涤干净的操作为。
(3)、反应Ⅱ后加入葡萄糖酸调节溶液pH至5.8,其原因是。(4)、葡萄糖酸亚铁溶液结晶、洗涤时均需加入乙醇,其目的分别是 , 。四、推断题
-
19. 化合物G是一种治疗帕金森症的药品,其合成路线流程图如下:
 (1)、D中的官能团名称为溴原子、和。(2)、B,C,D三种有机物与NaOH乙醇溶液共热,能发生消去反应的是(填字母)。(3)、写出同时满足下列条件的D的一种同分异构体的结构简式:。
(1)、D中的官能团名称为溴原子、和。(2)、B,C,D三种有机物与NaOH乙醇溶液共热,能发生消去反应的是(填字母)。(3)、写出同时满足下列条件的D的一种同分异构体的结构简式:。①分子中只有3种不同化学环境的氢;
②能发生银镜反应,苯环上的一取代物只有一种。
(4)、F通过取代反应得到G,G的分子式为C16H24N2O,写出G的结构简式:。(5)、已知: (R代表烃基或H)。
(R代表烃基或H)。 请写出以
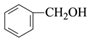 和CH3NO2为原料制备
和CH3NO2为原料制备  的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。五、综合题
-
20. 摩尔盐[(NH4)2Fe(SO4)2·6H2O]是一种重要的化工原料,可用于制取纳米Fe3O4和草酸合铁酸钾等。(1)、取一定质量摩尔盐样品与过量NaOH溶液反应。
①根据生成气体的体积计算得到摩尔盐的纯度小于实际值,其原因是。
②向所得Fe(OH)2沉淀中加入NaNO2溶液可制得纳米Fe3O4 , 同时产生NO。该反应的离子方程式为。
(2)、摩尔盐经氧化后与KOH和H2C2O4反应可得到草酸合铁酸钾[KaFeb(C2O4)c·dH2O],其中Fe元素化合价为+3。①已知25 ℃,H2C2O4的电离常数Ka1=5.6×10-2 , Ka2=5.4×10-5。pH=4的H2C2O4溶液中c(C2O ):c(HC2O )=。
②为了确定草酸合铁酸钾的组成,准确称取4.910 g样品在氮气气氛下加热,固体样品的剩余质量随温度的变化如图所示。
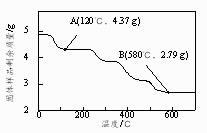
已知:a.120℃时已完全失去结晶水。
b.200℃~580℃分解产生的CO和CO2恢复至标准状况下体积为1.008 L。
c.580℃以上残留固体为FeO和K2CO3的混合物。
根据以上实验数据计算草酸合铁酸钾中的n(Fe3+):n(C2O42-)(写出计算过程)。
21. 粉煤灰的综合利既有利于节约资源又有利于保护环境。某粉煤灰(主要含Al2O3、Fe2O3、CaCO3等)的铝、铁分离工艺流程如下: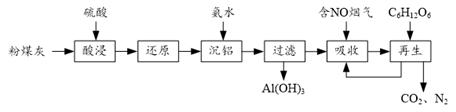 (1)、①“酸浸”时Al2O3发生反应的离子方程式为。
(1)、①“酸浸”时Al2O3发生反应的离子方程式为。②当硫酸质量分数大于50%,金属氧化物浸出率明显下降。其原因是。
(2)、有关金属离子以氢氧化物沉淀时离子浓度随pH变化如图-1所示。若浸出液不经还原直接与氨水混合,铝、铁元素分离效果较差的原因是。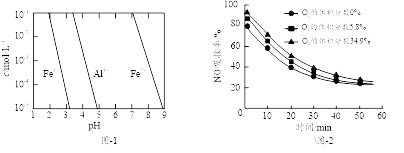 (3)、沉铝后所得FeSO4溶液可用于烟气中NO吸收,其原理为Fe2++2NO
(3)、沉铝后所得FeSO4溶液可用于烟气中NO吸收,其原理为Fe2++2NO [Fe(NO)2]2+ , 烟气中O2的体积分数对NO吸收率的影响如图-2所示。
[Fe(NO)2]2+ , 烟气中O2的体积分数对NO吸收率的影响如图-2所示。 ①为提高烟气中NO 的吸收率,可采取的措施有(答一条,并说明理由)。
②“再生”过程中,[Fe(NO)2]2+在微生物的作用下与C6H12O6发生反应的离子方程式为。
(4)、Al(OH)3经过一系列反应可获得粗铝,利用熔融状态下物质密度不同,通过三层液电解精炼法可由粗铝获得高纯铝(装置如图所示)。①该装置工作时,电极A作极。
②熔融粗铝时加入铜的作用是。
 22. 乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH(1)、Mn3+基态核外电子排布式为。(2)、NO
22. 乙酸锰可用于制造钠离子电池的负极材料。可用如下反应制得乙酸锰:4Mn(NO3)2·6H2O+26(CH3CO)2O=4(CH3COO)3Mn+8HNO2+3O2↑+40CH3COOH(1)、Mn3+基态核外电子排布式为。(2)、NO 中氮原子轨道的杂化类型是。 (3)、与HNO2互为等电子体的一种阴离子的化学式为。(4)、配合物[Mn(CH3OH)6]2+中提供孤对电子的原子是。(5)、CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还有。(6)、镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为。
中氮原子轨道的杂化类型是。 (3)、与HNO2互为等电子体的一种阴离子的化学式为。(4)、配合物[Mn(CH3OH)6]2+中提供孤对电子的原子是。(5)、CH3COOH能与H2O任意比混溶的原因,除它们都是极性分子外还有。(6)、镁铝合金经过高温淬火获得一种储钠材料,其晶胞为立方结构(如图所示),图中原子位于顶点或面心。该晶体中每个铝原子周围距离最近的镁原子数目为。
-