湖南省武冈市2017-2018学年高二下学期理综-化学模拟考试试卷
试卷更新日期:2018-06-13 类型:高考模拟
一、单选题
-
1. 下列过程不属于化学变化的是:( )A、煤的燃烧 B、石油分馏 C、大米酿酒 D、食物腐烂2. 下列物质属于盐的是( )A、Al2O3 B、NaOH C、NH4Cl D、HCl3. 下列各组离子在水溶液中能够大量共存的是( )A、OH -、 K+、NH4+ B、Ba2+、SO42-、H+ C、Ag+、 K+、Cl - D、Na+、 Cl -、 CO32-4. 关于苯的说法正确的是( )A、能发生取代反应 B、密度比水大 C、分子中存在单双键交替结构 D、能与水互溶5. 用红色激光照射下列物质,能观察到丁达尔效应的是( )A、乙醇溶液 B、牛奶 C、硫酸铜溶液 D、蔗糖溶液6. 下列物质属于电解质的是( )A、铝制导线 B、氨水 C、稀硫酸 D、硝酸钠7. 考古中常利用146C测定一些文物的年代。碳的146C核素的中子数是( )A、6 B、8 C、14 D、208. 下列离子方程式书写正确的是( )A、氯化亚铁溶液中通入氯气:Fe2+ +Cl2=Fe3+ +2Cl- B、稀硫酸滴在铜片上:Cu+2H+ = Cu2++H2↑ C、AlCl3溶液中加入足量的氨水:Al3++3OH-= Al(OH)3↓ D、Na2CO3溶液与稀HCl溶液混合CO32-+2H+=CO2↑+H2O9. 海水是重要的水资源,下列方法可用于淡化海水的是( )A、蒸馏法 B、过滤法 C、分液法 D、萃取法10. 下列物质不属于有机化合物的是( )A、酒精 B、醋酸 C、金刚石 D、甲烷11. 下列物质中,所含分子数最多的是(NA表示阿伏加德罗常数)是( )A、10 g H2 B、2mol Cl2 C、1.5NA CO2 D、22.4L O2(标准状况)12. 下列化合物中,只含有共价键的是( )A、氯化铵 B、甲烷 C、氯化钾 D、氢氧化钠13. 已知:2CH3CH2OH + O2 2CH3CHO+ 2H2O,该反应的反应类型是( )A、取代反应 B、加成反应 C、氧化反应 D、酯化反应14. 下列几种物质都是中学化学常见的酸,在相同条件下,酸性最强的是( )A、H2CO3 B、H2SiO3 C、H3PO4 D、H2SO415. 下列装置属于原电池装置的是( )A、
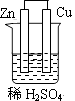 B、
B、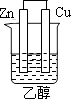 C、
C、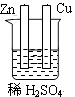 D、
D、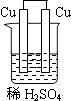 16. 下列有机物中,存在同分异构体的是( )A、CH4 B、CH3CH3 C、CH3CH2CH3 D、CH3CH2CH2CH317. 下列钠的化合物中,可用于呼吸面具作为O2来源的是( )A、Na2O B、Na2O2 C、NaCl D、Na2CO318. 下列行为中,符合安全要求的是( )A、节日期间,在任意场所燃放烟花爆竹 B、实验时,将水倒入浓硫酸配置稀硫酸 C、煤矿矿井,必须通风,严禁烟火 D、用点燃的火柴在液化气钢瓶口检验是否漏气19. 在工业上合成氨反应:N2+3H2 2NH3 ,欲增大反应速率,下列措施可行的是:( )A、降低温度 B、减小压强 C、减小H2的浓度 D、使用催化剂20. 下列化学反应中,属于吸热反应的是( )A、木炭燃烧反应 B、稀硫酸与烧碱反应 C、生石灰与水反应 D、Ba(OH)2·8H2O与NH4Cl晶体21. 利用铝热反应原理可以制取锰,化学方程式:3MnO2 +4Al 3Mn +2Al2O3。下列对该反应的叙述错误的是( )A、Al是还原剂 B、MnO2被还原 C、Mn是氧化产物 D、属于氧化还原反应22. 下列物质中,不能与盐酸反应的是( )A、Al B、Al2O3 C、Al(OH)3 D、AlCl3
16. 下列有机物中,存在同分异构体的是( )A、CH4 B、CH3CH3 C、CH3CH2CH3 D、CH3CH2CH2CH317. 下列钠的化合物中,可用于呼吸面具作为O2来源的是( )A、Na2O B、Na2O2 C、NaCl D、Na2CO318. 下列行为中,符合安全要求的是( )A、节日期间,在任意场所燃放烟花爆竹 B、实验时,将水倒入浓硫酸配置稀硫酸 C、煤矿矿井,必须通风,严禁烟火 D、用点燃的火柴在液化气钢瓶口检验是否漏气19. 在工业上合成氨反应:N2+3H2 2NH3 ,欲增大反应速率,下列措施可行的是:( )A、降低温度 B、减小压强 C、减小H2的浓度 D、使用催化剂20. 下列化学反应中,属于吸热反应的是( )A、木炭燃烧反应 B、稀硫酸与烧碱反应 C、生石灰与水反应 D、Ba(OH)2·8H2O与NH4Cl晶体21. 利用铝热反应原理可以制取锰,化学方程式:3MnO2 +4Al 3Mn +2Al2O3。下列对该反应的叙述错误的是( )A、Al是还原剂 B、MnO2被还原 C、Mn是氧化产物 D、属于氧化还原反应22. 下列物质中,不能与盐酸反应的是( )A、Al B、Al2O3 C、Al(OH)3 D、AlCl3二、填空题
-
23. 现有以下四种物质:A.
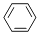 ,B.Ca(ClO)2 , C.NO2 , D.Si,请根据题意,选择恰当的选项用字母代号填空。 (1)、漂白粉的有效成分是;(2)、通常状况下带有特殊气味、不溶于水的液体是;(3)、通常状况下呈红棕色的是;(4)、电子工业中作为半导体材料的是。24. 乙醇和乙酸是生活中两种常见的有机物。请回答下列问题:(1)、乙醇的结构简式为CH3CH2OH,乙醇分子中含有的官能团是(填名称);(2)、生活中常用食醋除去暖瓶内的水垢(主要成分是CaCO3),反应的化学方程式2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+H2O。通过这个事实,你得出醋酸与碳酸的酸性强弱关系是:醋酸碳酸(填“>”或“<”);(3)、炒菜时,加入酒和醋能使菜味香可口,原因是酒和醋反应生成了(填“酯”或“盐”)。25. 下表列出了①~⑨九种元素在周期表中的位置。
,B.Ca(ClO)2 , C.NO2 , D.Si,请根据题意,选择恰当的选项用字母代号填空。 (1)、漂白粉的有效成分是;(2)、通常状况下带有特殊气味、不溶于水的液体是;(3)、通常状况下呈红棕色的是;(4)、电子工业中作为半导体材料的是。24. 乙醇和乙酸是生活中两种常见的有机物。请回答下列问题:(1)、乙醇的结构简式为CH3CH2OH,乙醇分子中含有的官能团是(填名称);(2)、生活中常用食醋除去暖瓶内的水垢(主要成分是CaCO3),反应的化学方程式2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+H2O。通过这个事实,你得出醋酸与碳酸的酸性强弱关系是:醋酸碳酸(填“>”或“<”);(3)、炒菜时,加入酒和醋能使菜味香可口,原因是酒和醋反应生成了(填“酯”或“盐”)。25. 下表列出了①~⑨九种元素在周期表中的位置。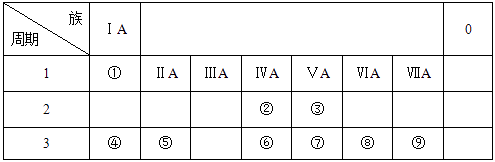
请按要求回答下列问题:
(1)、⑧的原子结构示意图是;(2)、③、⑤、⑦三种元素的原子半径由大到小的顺序是 (填元素符号);(3)、元素②的气态氢化物比元素⑥的气态氢化物的稳定性较 (填 “强”或“弱”);(4)、④和⑨两种元素组成的化合物与AgNO3溶液反应的离子方程式是。三、实验题
-
26. FeSO4·7H2O晶体在空气中易被氧化,为检验其是否已被氧化,可取少量样品溶于适量水后加入(填化学式)溶液检验;如已氧化,可向其中加入过量以除去其中的Fe3+ 。27. 某研究性学习小组参照课文中的实验装置图做高温下铁与水蒸气反应的实验装置如图所示。在玻璃管中放入铁粉与石棉绒的混合物,加热,并通入水蒸气。用试管收集产生的干燥气体,并靠近火焰点火,观察现象。
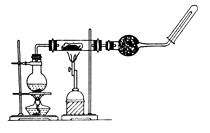
回答下列问题:
(1)、在圆底烧瓶内加入碎瓷片,其作用是_____(填字母代号)A、加快化学反应速率 B、防止溶液暴沸(2)、写出铁与高温下水蒸气反应的化学方程式;(3)、干燥管中盛装的物质是;(4)、点燃试管收集的气体前,则必须对该气体进行;(5)、实验时将铁粉与石棉绒混合以及在反应管的两端均放入少量石棉绒,其原因可能是(填序号)___________A、石棉绒的作用是催化剂 B、石棉绒受热均匀的作用是使铁粉 C、石棉绒的作用是作铁粉的载体以及防止铁粉被吹入导管而引起堵塞四、综合题
-
28. 人类的衣食住行都离不开化学,化学与生活密切相关。(1)、关注营养平衡,合理使用药物,有利于身心健康,现有下列四种物质:
A. 维生素
B. 葡萄糖
C. 青霉素
D. 碘酸钾
请根据题意,选择恰当的选项字母代号填空。
①人体内最重要的供能物质是;
②为预防甲状腺肿大,常在食盐中加入的物质是;
③能阻止多种细菌生长的重要抗生素是;
④存在于蔬菜、水果中,具有还原性的物质是。
(2)、材料是人类生存和发展的物质基础,合理使用材料可以节约资源。①下列生活中的常见物质,属于硅酸盐材料的是(填字母代号):
A. 汽车轮胎
B. 不锈钢
C. 水泥
②我国航天员穿的航天服主要是由具有密度小、强度大、耐腐蚀、柔软等优良性能的特殊材料制成,这些材料属于(填字母代号):
A. 镁铝合金
B. 合成纤维
C. 天然纤维
③生产和生活中,合金无处不在。我国最早使用的合金是(填“铜合金”或“铝合金”);
(3)、当前,环境治理已成为重要的民生工程。①我国城市发布的“空气质量日报”中,下列物质不列入首要污染物的是(填字母代号):
A. 二氧化硫
B. 二氧化碳
C. 二氧化氮
D. 可吸入颗粒物
②水是一种宝贵的资源,保护水资源就是保护我们的生命。下列做法不利于水资源保护的是;
A. 科学合理使用农药
B. 任意排放化工厂废水
C. 处理生活污水,达标排放
③下列处理垃圾的方法中,错误的是。
A.回收利用废纸
B.回收利用易拉罐
C.填埋废旧电池
29.(1)、①25℃时,NH4Cl溶液呈酸性,原因是水解引起的(填“NH4+”或“Cl-”);②常温下,0.0100mol/L NaOH溶液的pH=;
③用0.0100mol/L 盐酸滴定未知浓度的NaOH溶液,酚酞作指示剂,滴定终点时,溶液的颜色由浅红色变为(填“蓝色”或“无色”),且半分钟内颜色保持不变。
④ 已知在25℃:AgCl(s) Ag+(aq)+Cl-(aq) Ksp=1.8×10-10
Ag2S(s) 2Ag+(aq)+S2-(aq) Ksp=6.3×10-50
向浓度均为0.001 mol/L的NaCl和Na2S的混合溶液中,逐滴加入AgNO3溶液,最先产生的沉淀是(填“AgCl”或“Ag2S”)。
(2)、已知25℃合成氨反应中,1mol N2完全转化为NH3时释放的能量为92.4 kJ。现将1mol N2和3mol H2混合置于2L密闭容器中,反应进行到2s末测得NH3为0.4mol。回答下列:
① 该反应的热化学方程式是 ;
② 该反应达到平衡后,升高温度平衡向 (填“正”、“逆”)反应方向移动;加入催化剂平衡(填“正”、“逆”、 “不”)移动;
③ 前2s内v(H2)是。
(3)、燃料电池能量转化率高,具有广阔的发展前景。天然气燃料电池中,在负极发生反应的物质是 (填化学式);如果该电池中的电解质溶液是KOH溶液,电极B电极上发生的电极反应式是:。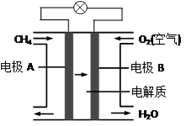 。
。