湖北省宜昌市2017-2018学年高考理综-化学4月模拟考试试卷
试卷更新日期:2018-06-13 类型:高考模拟
一、单选题
-
1. 化学与生活密切相关,下列有关说法中错误的是( )A、生活中常用的铝制品与不锈钢均不易腐蚀 B、日常生活中,小苏打常用作食用碱使用而苏打不能 C、在牙膏中添入 Na2PO3F、 NaF, 能起到预防龋齿的作用 D、向含有纯碱的废水中加入适量生石灰,不能消除水的污染2. 中医典籍《肘后备急方》所载治疗疟疾的方法“青蒿一握,以水二升渍,绞取汁,尽服之”, 对屠呦呦团队研发治疗疟疾的特效药——青蒿素有巨大的启示作用。屠呦呦在对比实验中发现古法疗效低下,她设计的提取青蒿素的工艺可以简化成如下流程:
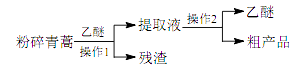
根据上述信息分析,下列判断或叙述中肯定错误的是( )
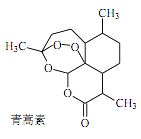
A、从天然植物中提取有效成分治疗疾病是药物研发的重要途径 B、将青蒿粉碎可以提高有效成分的提取率 C、青蒿素易溶于水和乙醚 D、操作 1 是过滤,操作 2 是蒸馏3. 关于有机物 的说法正确的是( ) A、a、b互为同系物 B、c 中所有碳原子可能处于同一平面 C、b 的同分异构体中含有羧基的结构还有 7 种(不含立体异构) D、a、b、 c 均能使酸性高锰酸钾溶液褪色4. 草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。
的说法正确的是( ) A、a、b互为同系物 B、c 中所有碳原子可能处于同一平面 C、b 的同分异构体中含有羧基的结构还有 7 种(不含立体异构) D、a、b、 c 均能使酸性高锰酸钾溶液褪色4. 草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。
下列说法正确的是( )
A、若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO B、实验时只需要在装置①中反应结束后再通入N2 C、若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气 D、实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁5. 锂-空气电池的工作原理如图所示。其中多孔电极材料选用纳米多孔金时, 该电池表现出良好的循环性能。电池反应为: 2Li+O2=Li2O2。 下列说法错误的是( )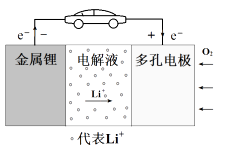 A、该电池的电解液常用锂盐的有机溶液 B、电池工作时,外电路中流过 0.01 mol 电子,负极材料减重 0.07g C、电池工作时,正极反应可能经过两个过程: Li++O2+e-=LiO2 Li++LiO2+e-=Li2O2 D、电池充电时间越长,电池中 Li2O2越多6. A、B、C、D 均为短周期主族元素, 原子序数依次增大,其原子的最外层电子数之和为 18, A 和 C 同主族, B 原子的电子层数与最外层电子数相等,B、 C、 D 的单质均可与 NaOH 溶液反应。下列说法正确的是( )A、简单离子半径: D>B B、简单氢化物的热稳定性: C>A C、AD4 的熔沸点比 CD4的高 D、可电解BD3制备 B 的单质7. 羟胺的电离方程式为: NH2OH+H2O NH3OH++OH-( 25℃时, Kb=9.0×10-9)。用 0.1 mol·L-1 盐酸滴定 20 mL 0.1mol·L-1 羟胺溶液,恒定 25℃时,滴定过程中由水电离出来的 H+浓度的负对数与盐酸体积的关系如图所示(已知: lg3=0.5)。下列说法正确的是( )
A、该电池的电解液常用锂盐的有机溶液 B、电池工作时,外电路中流过 0.01 mol 电子,负极材料减重 0.07g C、电池工作时,正极反应可能经过两个过程: Li++O2+e-=LiO2 Li++LiO2+e-=Li2O2 D、电池充电时间越长,电池中 Li2O2越多6. A、B、C、D 均为短周期主族元素, 原子序数依次增大,其原子的最外层电子数之和为 18, A 和 C 同主族, B 原子的电子层数与最外层电子数相等,B、 C、 D 的单质均可与 NaOH 溶液反应。下列说法正确的是( )A、简单离子半径: D>B B、简单氢化物的热稳定性: C>A C、AD4 的熔沸点比 CD4的高 D、可电解BD3制备 B 的单质7. 羟胺的电离方程式为: NH2OH+H2O NH3OH++OH-( 25℃时, Kb=9.0×10-9)。用 0.1 mol·L-1 盐酸滴定 20 mL 0.1mol·L-1 羟胺溶液,恒定 25℃时,滴定过程中由水电离出来的 H+浓度的负对数与盐酸体积的关系如图所示(已知: lg3=0.5)。下列说法正确的是( )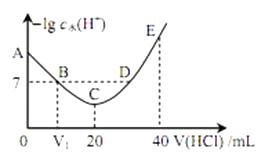 A、图中 V1>10 B、A 点对应溶液的 pH=9.5 C、B, D 两点对应的溶液均为中性 D、E 点对应溶液中存在:c(H+)=c (OH-)+c (NH3OH+)+c (NH2OH)
A、图中 V1>10 B、A 点对应溶液的 pH=9.5 C、B, D 两点对应的溶液均为中性 D、E 点对应溶液中存在:c(H+)=c (OH-)+c (NH3OH+)+c (NH2OH)二、实验题
-
8. 某课题组同学受葡萄糖与新制氢氧化铜悬浊液反应实验的启示,拟设计实验利用氧化铜探究乙醛的还原性。(1)、【提出猜想】 猜想 1: CH3CHO+2CuO CH3COOH+Cu2O;
猜想 2: (写出化学方程式)。
(2)、【定性实验】甲同学设计下图装置进行实验(部分夹持装置已略去):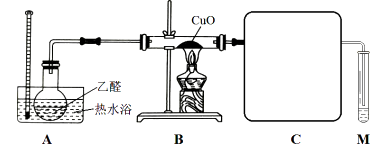
已知: 乙醛和乙酸的沸点分别为 20.8℃、 117.9℃。
按上述装置进行实验,当氧化铜完全反应后停止实验。
①为达到良好的冷凝效果,方框中 C 装置应选用(填仪器名称);实验中先通入乙醛蒸气,后点燃装置 B 处酒精灯,这样操作的目的是。
②已知: Cu2O 呈红色,在酸性条件下发生反应 Cu2O+2H+=Cu+Cu2++H2O。 请你设计实验证明猜想 1 成立。
实验操作: 。
实验现象: 。
(3)、【定量实验】乙同学设计了如下图所示实验方案定量探究红色固体的成分。
已知:醋酸亚铬[Cr(CH3COO)2]溶液可以吸收少量的 O2。
①下列有关说法正确的是(填标号) 。
a. 装置 D 可以控制反应的发生与停止
b. 装置 F 中盛装醋酸亚铬溶液
c. 向装置 D 中加入少量硫酸铜固体可加快反应
d. 实验中观察到装置 G 中有明显现象
②装置 G 中红色粉末完全反应后,称得固体粉末质量为 19.2 g;装置 H 净增质量为2.0 g。请选择合理数据计算,确定红色粉末的成分及物质的量: 。
三、推断题
-
9. 工业上制备 BaCl2·2H2O 有如下两种途径。
途径 1:以重晶石(主要成分 BaSO4)为原料,流程如下:
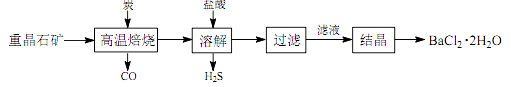 (1)、写出“高温焙烧”时反应的化学方程式: 。(2)、“高温焙烧” 时必须加入过量的炭,同时还要通入空气,其目的是。
(1)、写出“高温焙烧”时反应的化学方程式: 。(2)、“高温焙烧” 时必须加入过量的炭,同时还要通入空气,其目的是。途径 2:以毒重石(主要成分 BaCO3 , 含 Ca2+、 Mg2+、 Fe3+等杂质)为原料,流程如下:
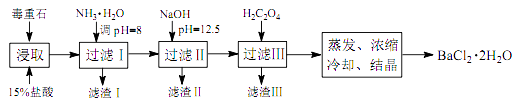
已知: Ksp(BaC2O4)=1.6×10-7 , Ksp(CaC2O4)=2.3×10-9
Ca2+
Mg2+
Fe3+
开始沉淀时的 pH
11.9
9.1
1.9
完全沉淀时的 pH
13.9
11.1
3.7
(3)、为提高矿石的浸取率,可采取的措施是。(4)、加入NH3·H2O 调节 pH=8 可除去 (填离子符号),滤渣Ⅱ中含(填化学式)。加入 H2C2O4时应避免过量,原因是。(5)、重量法测定产品纯度的步骤为:准确称取 mg BaCl2·2H2O 试样,加入 100 mL 水, 用 3 mL 2 mol·L-1 的 HCl 溶液加热溶解。边搅拌,边逐滴加入 0.1 mol·L-1 H2SO4 溶液。待 BaSO4 完全沉降后,过滤,用0.01 mol·L-1 的稀H2SO4洗涤沉淀 3~4 次,直至洗涤液中不含 Cl-为止。将沉淀置于坩埚中经烘干灼烧至恒重,称量为 n g。则BaCl2·2H2O的质量分数为。
10. 化合物H是一种抗病毒药物,在实验室中利用芳香烃 A 制备 H 的流程如下图所示(部分反应条件已略去):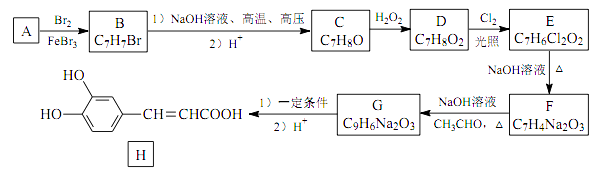
已知: ①有机物 B 苯环上只有两种不同环境的氢原子;
②两个羟基连在同一碳上不稳定,易脱水形成羰基或醛基;
③ RCHO + CH3CHO NaOH RCH CHCHO + H2O; ④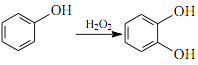 (1)、有机物 B 的名称为。(2)、由D生成 E 的反应类型为 , E 中官能团的名称为。(3)、由 G 生成 H 所需的“一定条件” 为。(4)、写出 B 与 NaOH 溶液在高温、 高压下反应的化学方程式:。(5)、F 酸化后可得 R, X 是 R 的同分异构体, X 能发生银镜反应,且其核磁共振氢谱显示有 3 种不同化学环境的氢,峰面积比为 1∶1∶1,写出 2 种符合条件的 X 的结构简式:。(6)、设计由
(1)、有机物 B 的名称为。(2)、由D生成 E 的反应类型为 , E 中官能团的名称为。(3)、由 G 生成 H 所需的“一定条件” 为。(4)、写出 B 与 NaOH 溶液在高温、 高压下反应的化学方程式:。(5)、F 酸化后可得 R, X 是 R 的同分异构体, X 能发生银镜反应,且其核磁共振氢谱显示有 3 种不同化学环境的氢,峰面积比为 1∶1∶1,写出 2 种符合条件的 X 的结构简式:。(6)、设计由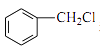 和丙醛合成
和丙醛合成 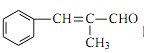 的流程图:(其他试剂任选)。
的流程图:(其他试剂任选)。 四、综合题
-
11. 消除氮氧化物和硫氧化物有多种方法。(1)、用活性炭还原法: 某研究小组向某密闭容器中加入足量的活性炭和 NO,发生反应:C(s)+2NO(g) N2(g)+CO2(g) △H=Q kJ·mol-1 在 T1℃下,反应进行到不同时间测得各物质的浓度部分数据如下:
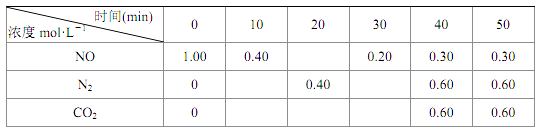
①0~10 min 内, N2 的平均反应速率 υ(N2)= , T1℃时,该反应的平衡常数 K=。
②30min后,若只改变一个条件,反应重新达到平衡时各物质的浓度如上表所示,则改变的条件可能是 (填字母)
a. 加入一定量的活性炭
b. 改变反应体系的温度
c. 缩小容器的体积
d. 通入一定量的 NO
③若 30 min 后升高温度至 T2℃,重新达到平衡时,容器中 NO、 N2、 CO2 的浓度之比为 7∶3∶3,则该反应的DH0(填“>” 、 “ =” 、或“<” )
(2)、NH3 催化还原法: 原理如图所示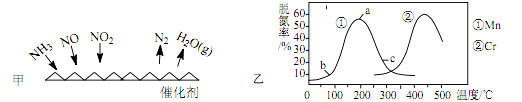
①若烟气中 c(NO2):c(NO)=1∶1,发生如图甲所示的脱氮反应时,反应过程中转移 1.5mol 电子时放出的热量为 113.8 kJ,则发生该脱氮反应的热化学方程式为。
②图乙是在一定时间内,使用不同催化剂Mn和Cr在不同温度下对应的脱氮率,由图可知工业使用的最佳催化剂和相应温度分别为 ;使用 Mn 作催化剂时,脱氮率 b~a 段呈现如图变化的可能原因是。
(3)、已知常温下 Ka1(H2SO3)=1.8´10-2 , Ka2(H2SO3)=6.0´10-9。 汽车尾气中的 SO2用石灰水来吸收,生成的 CaSO3 浊液 pH=9.0,忽略 SO32-的第二步水解,则Ksp(CaSO3)=。五、填空题
-
12. 非金属硼的合金及其化合物有着广泛的用途。(1)、硼钢合金的硬度是普通钢材的 4 倍,其主要成分是铁。 画出基态铁原子的价电子排布图。(2)、氨硼烷(NH3BH3)是一种新型储氢材料,其分子中存在配位键, 则氨硼烷分子结构式为。写出一种与氨硼烷互为等电子体的分子(填化学式)。(3)、常温常压下硼酸(H3BO3)晶体结构为层状,其二维平面结构如右图所示。
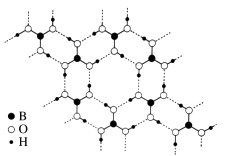
①1 mol H3BO3晶体中含有mol 氢键。
②请从氢键的角度解释硼酸在冷水中的溶解度小而加热时溶解度增大的原因:。
(4)、硼氢化钠是一种常用的还原剂。其晶胞结构如右图所示: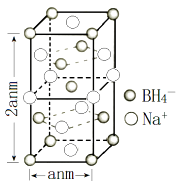
①该晶体中Na+的配位数为。
②H3BO3 分子中的 O—B—O 的键角(填“大于”、“等于”或“小于”) BH4-中的 H—B—H 的键角,判断依据是。
③已知硼氢化钠晶体的密度为 ρ g/cm3 , NA代表阿伏加德罗常数的值,则 a=(用含 ρ、 NA的代数式表示);④若硼氢化钠晶胞上下底心处的 Na+被 Li+取代,得到的晶体的化学式为。
-
-