湖北省武汉市2017-2018学年高考理综-化学5月模拟考试试卷
试卷更新日期:2018-06-13 类型:高考模拟
一、单选题
-
1. 化学与生活密切相关。下列说法中错误的是( )A、护肤品中加入甘油是利用甘油的芳香气味 B、肥皂水做蚊虫叮咬处的清洗剂是利用肥皂水的弱碱性 C、月饼包装盒中的铁粉可以起到抗氧化作用 D、用浸泡过KMnO4溶液的硅藻土保鲜水果是利用KMnO4的氧化性2. 设NA为阿伏加德罗常数的值。下列说法正确的是( )A、100gKHCO3晶体中含有的离子数为3NA B、一定条件下,将71gCl2和足量的PCl3混合充分反应,可得到NA个PCl5分子 C、3molFe在纯氧中完全燃烧转移的电子数为8NA D、标准状况下,22.4L正戊烷中含有共价键的数目为16NA3. 金刚烷(
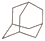 )可看成由四个椅式环己烷(
)可看成由四个椅式环己烷(  )构成。下列说法正确的是( ) A、金刚烷的分子式为C10H14 B、金刚烷的二溴代物有6种 C、金刚烷能被酸性KMnO4溶液氧化 D、金刚烷的同分异构体中有可能存在苯的同系物4. 现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且甲、乙、丙均为10电子的分子,Y、Z结合生成化合物丁。有关物质的转化关系如下图所示,下列说法错误的是( )
)构成。下列说法正确的是( ) A、金刚烷的分子式为C10H14 B、金刚烷的二溴代物有6种 C、金刚烷能被酸性KMnO4溶液氧化 D、金刚烷的同分异构体中有可能存在苯的同系物4. 现有W、X、Y、Z四种短周期元素,W分别与X、Y、Z结合生成甲、乙、丙三种化合物,且甲、乙、丙均为10电子的分子,Y、Z结合生成化合物丁。有关物质的转化关系如下图所示,下列说法错误的是( )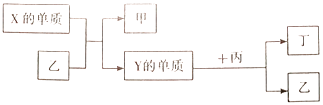 A、原子序数由小到大的顺序是:W<Z<Y<X B、化合物的沸点由高到低的顺序是:乙>甲>丙 C、Z的最高价氧化物对应的水化物一定为强酸 D、Y与W、Z都能形成两种或两种以上的化合物5. 向两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。下列说法正确的是( )
A、原子序数由小到大的顺序是:W<Z<Y<X B、化合物的沸点由高到低的顺序是:乙>甲>丙 C、Z的最高价氧化物对应的水化物一定为强酸 D、Y与W、Z都能形成两种或两种以上的化合物5. 向两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。下列说法正确的是( ) A、a、d两点的溶液中Ba2+均恰好沉淀完全 B、b点的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O C、d点溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-) D、溶液中由水电离的c(OH-)大小关系:a=d>c>b滴入溶液的体积6. 为探究硫酸亚铁的分解产物,将硫酸亚铁装入下图所示的装置a中,打开K1和K2 , 缓缓通入N2 , 加热。实验后反应管中残留固体为红色粉末。下列说法中正确的是( )
A、a、d两点的溶液中Ba2+均恰好沉淀完全 B、b点的离子方程式为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O C、d点溶液中:c(Na+)+c(H+)=c(SO42-)+c(OH-) D、溶液中由水电离的c(OH-)大小关系:a=d>c>b滴入溶液的体积6. 为探究硫酸亚铁的分解产物,将硫酸亚铁装入下图所示的装置a中,打开K1和K2 , 缓缓通入N2 , 加热。实验后反应管中残留固体为红色粉末。下列说法中正确的是( )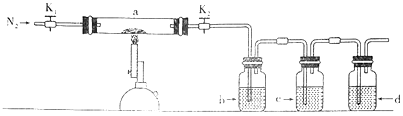 A、分解的气体产物中有SO3、SO2 , 应该先检验SO3 B、装置b中的试剂为Ba(NO3)2溶液,反应后有白色沉淀生成 C、装置c中的试剂为酸性KMnO4溶液,作用是除去混合气体中的SO2 D、装置d之后需要增加尾气处理装置7. 温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g) 2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是( )
A、分解的气体产物中有SO3、SO2 , 应该先检验SO3 B、装置b中的试剂为Ba(NO3)2溶液,反应后有白色沉淀生成 C、装置c中的试剂为酸性KMnO4溶液,作用是除去混合气体中的SO2 D、装置d之后需要增加尾气处理装置7. 温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应:2NO2(g) 2NO(g)+O2(g)相关数据如下表所示。下列说法错误的是( )容器
编号
物质的起始浓度
(mol·L-1)
物质的平衡浓度
(mol·L-1)
c(NO2)
c(NO)
c(O2)
c(O2)
Ⅰ
0.6
0
0
0.2
Ⅱ
0.3
0.5
0.2
Ⅲ
0
0.5
0.35
A、容器Ⅰ中发生反应的平衡常数为0.8 B、容器Ⅱ中发生反应的起始阶段有v正>v逆 C、达到平衡时,容器Ⅲ中 >1 D、达到平衡时,容器Ⅰ与容器Ⅲ中的总压强之比为16∶17二、综合题
-
8. 硼酸三甲酯用作柠檬类水果的熏蒸剂。实验室合成硼酸三甲酯的原理及装置如下:
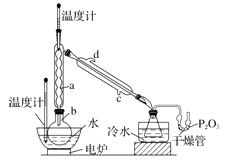
硼酸三甲酯
甲醇
溶解性
与乙醚、甲醇混溶,能水解
与水混溶
沸点/℃
68
64
硼酸三甲酯与甲醇混合物的共沸点为54℃
Na2B4O7·10H2O+2H2SO4+16CH3OH 2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O
实验步骤如下:
①在圆底烧瓶中加入44.8 g 甲醇和19.1gNa2B4O7·10H2O (硼砂,式量为382),然后缓慢加入浓H2SO4 并振荡;加热烧瓶中的液体;通过分馏柱回流一段时间。
②先接收51~55℃的馏分,再接收55~60℃的馏分。
③将两次馏分合并,加入氯化钙进行盐析分层,上层为硼酸三甲酯,分离。
④精馏得高纯硼酸三甲酯19.2 g。
回答下列问题:
(1)、图中仪器a的名称为;直形冷凝管冷却水应从(填“b”或“c”)接口进入。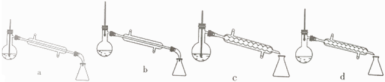 (2)、本实验加热方式为 , 优点是。(3)、加入氯化钙盐析分层的主要目的是。(4)、U 型管中P2O5 的作用是。(5)、步骤④的仪器选择及安装都正确的是 (填标号),应收集℃的馏分。(6)、本次实验的产率是。9. 以化工厂铬渣( 含有Na2SO4及少量Cr2O72-、Fe3+)为原料提取硫酸钠的工艺流程如下:
(2)、本实验加热方式为 , 优点是。(3)、加入氯化钙盐析分层的主要目的是。(4)、U 型管中P2O5 的作用是。(5)、步骤④的仪器选择及安装都正确的是 (填标号),应收集℃的馏分。(6)、本次实验的产率是。9. 以化工厂铬渣( 含有Na2SO4及少量Cr2O72-、Fe3+)为原料提取硫酸钠的工艺流程如下: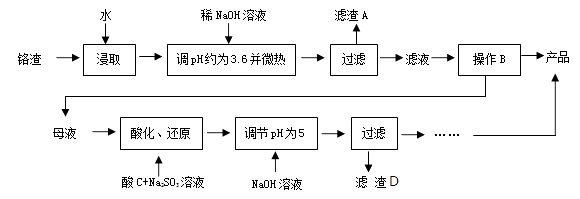
已知:Fe3+、Cr3+完全沉淀(c≤1.0×10-5mol·L-1)时pH分别为3.6和5。
回答下列问题:
(1)、根据下图信息,操作B的最佳方法是。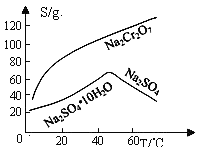 (2)、“母液”中主要含有的离子为。(3)、酸化后的Cr2O72-可被SO32-还原,该反应的离子方程式为。(4)、酸化、还原操作时,酸C 和Na2SO3溶液是(填“先后加入”或“混合后加入”),理由是。(5)、若pH=4.0时,溶液中Cr3+尚未开始沉淀,则溶液中允许Cr3+浓度的最大值为。(6)、根据2CrO42-+2H+ Cr2O72-+H2O 设计图示装置,以惰性电极电解Na2CrO4溶液制取Na2Cr2O7 , 图中右侧电极与电源的极相连,其电极反应式为。透过交换膜的离子为 , 该离子移动的方向为 (填“a→b”或“b→a”)。
(2)、“母液”中主要含有的离子为。(3)、酸化后的Cr2O72-可被SO32-还原,该反应的离子方程式为。(4)、酸化、还原操作时,酸C 和Na2SO3溶液是(填“先后加入”或“混合后加入”),理由是。(5)、若pH=4.0时,溶液中Cr3+尚未开始沉淀,则溶液中允许Cr3+浓度的最大值为。(6)、根据2CrO42-+2H+ Cr2O72-+H2O 设计图示装置,以惰性电极电解Na2CrO4溶液制取Na2Cr2O7 , 图中右侧电极与电源的极相连,其电极反应式为。透过交换膜的离子为 , 该离子移动的方向为 (填“a→b”或“b→a”)。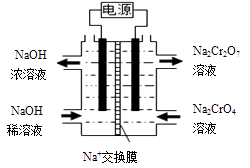 10. 乙二酸(H2C2O4)俗称草酸,是二元弱酸。回答下列问题:(1)、在恒温、恒容密闭容器中发生反应:H2C2O4(s) H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是____________(填标号)。A、压强不再变化 B、CO2(g)的体积分数保持不变 C、混合气体密度不再变化 D、混合气体平均摩尔质量保持不变(2)、草酸溶液中各离子浓度分数δ(X)随溶液pH变化的关系如图所示:
10. 乙二酸(H2C2O4)俗称草酸,是二元弱酸。回答下列问题:(1)、在恒温、恒容密闭容器中发生反应:H2C2O4(s) H2O(g)+CO(g)+CO2(g),下列描述能说明反应已经达到平衡状态的是____________(填标号)。A、压强不再变化 B、CO2(g)的体积分数保持不变 C、混合气体密度不再变化 D、混合气体平均摩尔质量保持不变(2)、草酸溶液中各离子浓度分数δ(X)随溶液pH变化的关系如图所示: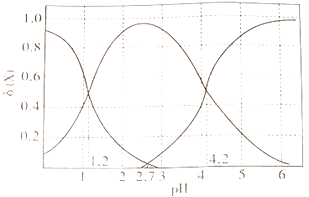
①当溶液中含碳粒子的主要存在形态为C2O42-时,溶液的酸碱性为(填标号)。
A.强酸性
B.弱酸性
C.中性
D.碱性
②25℃时,反应C2O42-+H2C2O4- 2HC2O4-的平衡常数的对数值1gK=。
(3)、向10 mL0.1mol·L-1H2C2O4溶液中逐滴加入0.1mol·L-1NaOH溶液,当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,加入V(NaOH)10 mL(填“>”“=”或“<”)。(4)、草酸晶体(H2C2O4·2H2O)为无色,某同学设计实验测定其纯度。实验过程如下:称取m g草酸晶体于试管中,加水完全溶解用cmol·L-1酸性KMnO4标准溶液进行滴定,则达到滴定终点时的现象是; 该过程中发生反应的离子方程式为;滴定过程中消耗V mL KMnO4标准溶液,草酸晶体纯度为。11. 砷(As)是VA 族元素,砷及其化合物被应用于农药和合金中。回答下列问题:(1)、基态砷原子的电子排布式为 , 第四周期元素中,第一电离能低于砷原子的p区元素有 (填元素符号)。(2)、氮原子间能形成氮氮叁键,而砷原子间不易形成叁键的原因是。(3)、AsH3分子为三角锥形,键角为91.80°,小于氨分子键角107°,AsH3分子键角较小的原因是。(4)、亚砷酸( H3AsO3)分子中,中心原子砷的VSEPR 模型是 , 砷原子杂化方式为。(5)、砷化镍的晶胞如图。晶胞参数a=360.2 pm, c=500.9 pm, γ=120°。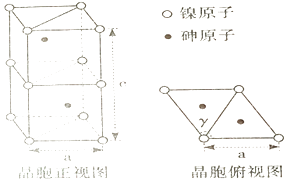
①镍原子配位数为 , 配原子构成的几何体是。
②该晶体密度的计算式为g·cm-3。
12. 链烃A 是重要的有机化工原料,由A 经以下反应可制备一种有机玻璃: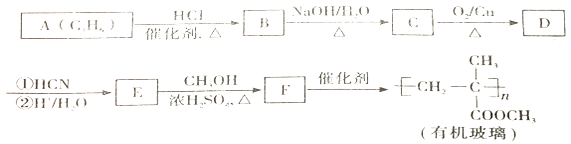
已知:羰基化合物可发生以下反应:
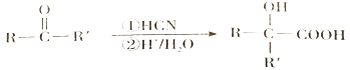
(注:R'可以是烃基,也可以是H 原子)
回答下列问题:
(1)、A 分子中官能团的结构简式为 , 分子结构鉴定时,获取官能团信息的仪器是。(2)、B 生成C 的反应类型为。(3)、核磁共振氢谱表明D 只有一种化学环境的氢,D 的结构简式为 , 分子中最多有个原子共平面。(4)、E 发生酯化、脱水反应生成F 的化学方程式为。(5)、F的同分异构体中能同时满足下列条件的共有种(不含立体异构)。①能与饱和NaHCO3 溶液反应产生气体 ②能使Br2的四氯化碳溶液褪色
其中核磁共振氢谱显示为3 组峰,且峰面积比为6∶1∶1的结构简式为。
(6)、聚丙烯酸钠(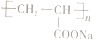 )是一种高吸水性树脂。参考上述信息,设计由乙醇制备该高聚物单体的合成线路。
)是一种高吸水性树脂。参考上述信息,设计由乙醇制备该高聚物单体的合成线路。