湖北省2017-2018学年高考理综-化学模拟考试试卷
试卷更新日期:2018-06-13 类型:高考模拟
一、单选题
-
1. 化学与生活、社会密切相关,下列说法正确的是( )A、高锰酸钾溶液、二氧化硫、酒精都能杀菌消毒,都利用了强氧化性 B、将矿物燃料脱硫脱硝可有效防止酸雨 C、通信光缆的主要成分是晶体Si,太阳能电池的材料主要是SiO2 D、以“地沟油”为原料生产的生物柴油与以“石油”为原料生产的柴油化学成分相似2. 《本草纲目》中有“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”的记载。下列说法正确的是( )A、“薪柴之灰”可与铵态氮肥混合施用 B、“以灰淋汁”的操作是萃取 C、“取碱”得到的是一种碱溶液 D、“浣衣”过程有化学变化3. 化合物W、X、Y、Z的分子式均为C8H10 , Z的空间结构类似于篮子。下列说法正确的是( )
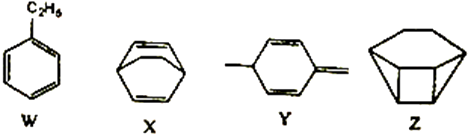 A、化合物W的同分异构体只有X、Y、Z B、W、X、Y、Z中能使酸性KMnO4溶液褪色的有2种 C、W、Z的一氯代物中数目较少的Z D、1molX、1molY 与足量Br2/CCl4溶液反应最多消耗Br2均为2mol4. 手持技术的氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图。已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg。下列说法正确的是( )
A、化合物W的同分异构体只有X、Y、Z B、W、X、Y、Z中能使酸性KMnO4溶液褪色的有2种 C、W、Z的一氯代物中数目较少的Z D、1molX、1molY 与足量Br2/CCl4溶液反应最多消耗Br2均为2mol4. 手持技术的氧电化学传感器可用于测定O2含量,下图为某种氧电化学传感器的原理示意图。已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为aL(标准状况),某电极增重了bg。下列说法正确的是( )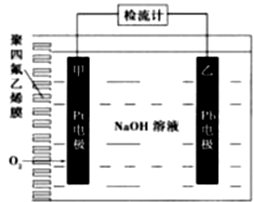 A、Pt上发生氧化反应 B、Pb上发生的电极反应式为Pb-2e-+2OH-=Pb(OH)2 C、反应过程中转移OH-的物质的量为0.25bmol D、待测气体中氧气的体积分数为0.7b/a5. 某学习小组设计实验制备供氢剂氢化钙(CaH2),实验装置如下图所示。
A、Pt上发生氧化反应 B、Pb上发生的电极反应式为Pb-2e-+2OH-=Pb(OH)2 C、反应过程中转移OH-的物质的量为0.25bmol D、待测气体中氧气的体积分数为0.7b/a5. 某学习小组设计实验制备供氢剂氢化钙(CaH2),实验装置如下图所示。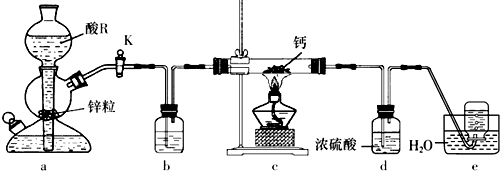
已知:氢化钙遇水剧烈反应。
下列说法正确的是( )
A、相同条件下,粗锌(含少量铜)比纯锌反应速率慢 B、酸R为浓盐酸,装置b中盛装浓硫酸 C、装置d的作用是除去氢气中的杂质,得到干燥纯净的氢气 D、实验结束后先熄灭酒精灯,等装置冷却后再关闭活塞K6. 短周期元素W、X、Y、Z的原子序数依次增大,这些元素组成的单质和化合物转化关系如下图所示。其中C是淡黄色固体,B和E的水溶液均具有漂白性。下列说法错误的是( )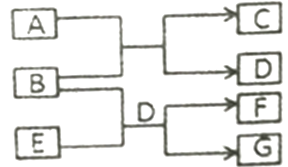 A、简单离子半径:Y>Z>X B、沸点:D<A C、气态氢化物稳定性:Z>Y D、0.1mol·L-1A溶液中:c(H+)>c(HY-)>c(Y2-)7. 已知Ka(CH3COOH)=1.7×10-5 , Kb(NH3·H2O)=1.7×10-5。25℃时,向40mL浓度均为0.01mol·L-1的盐酸和醋酸(1:1)混合溶液中逐滴加入0.10mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法正确的是( )
A、简单离子半径:Y>Z>X B、沸点:D<A C、气态氢化物稳定性:Z>Y D、0.1mol·L-1A溶液中:c(H+)>c(HY-)>c(Y2-)7. 已知Ka(CH3COOH)=1.7×10-5 , Kb(NH3·H2O)=1.7×10-5。25℃时,向40mL浓度均为0.01mol·L-1的盐酸和醋酸(1:1)混合溶液中逐滴加入0.10mol·L-1的氨水,测定过程中电导率和pH变化曲线如图所示,下列说法正确的是( )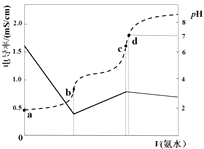 A、a点溶液中,c(CH3COO-)数量级约为10-5 B、b点溶液中,c(NH4+) < c(CH3COOH) C、c点溶液中,c(NH4+) > c(Cl-)+c(CH3COO-) D、d点水的电离程度大于c点
A、a点溶液中,c(CH3COO-)数量级约为10-5 B、b点溶液中,c(NH4+) < c(CH3COOH) C、c点溶液中,c(NH4+) > c(Cl-)+c(CH3COO-) D、d点水的电离程度大于c点二、综合题
-
8. 某小组研究溶液中Fe2+与NO2-、NO3-的反应。
实验I
试剂
现象
滴管
试管

2mL
1mol·L-1 FeSO4溶液(pH=4)
1mol·L-1 NaNO2溶液(pH=8)
a.滴入1滴FeSO4溶液,溶液变黄色,继续滴加,溶液变为棕色。2小时后,无明显变化
1mol·L-1 NaNO3溶液(加NaOH溶液至pH=8)
b.持续滴加FeSO4溶液,无明显变化。
资料:[Fe(NO)]2+在溶液中呈棕色。[Fe(NO)]2+ Fe2++NO。
(1)、研究现象a中的黄色溶液。①用溶液(填试剂名称)检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是。
③进行实验Ⅱ,装置如图。证实了Fe2+被NO2-氧化为Fe3+。装置左侧烧杯中的试剂为: , 实验过程中右侧电极上产生无色气泡,电极反应式为 , 左侧烧杯中的现象为:。
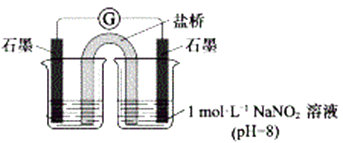 (2)、研究现象a中的棕色溶液。
(2)、研究现象a中的棕色溶液。①综合实验Ⅰ和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是。
(3)、研究酸性条件下,溶液中Fe2+与NO2-、NO3-的反应。序号
操作
现象
ⅰ
取1 mol·L-1的NaNO2溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液
溶液立即变为棕色
ⅱ
取1 mol·L-1的NaNO3溶液,加醋酸至pH=3,加入1 mol·L-1FeSO4溶液
无明显变化
ⅲ
分别取0.5 mL 1 mol·L-1的NaNO3溶液与1 mol·L-1的FeSO4溶液,混合,小心加入0.5 mL浓硫酸
液体分为两层,稍后,在两层液体界面上出现棕色环
①ⅰ中溶液变为棕色的离子方程式是、Fe2++NO =[Fe(NO)]2+。
②ⅲ中出现棕色的原因是。
实验结论:本实验条件下,溶液中NO2−、NO3−的氧化性与溶液的酸碱性等有关。
9. 二氧化铈(CeO2)是一种重要的稀士氧化物。以氟碳铈矿(主要含CeFCO3)为原料制备CeO2的一种工艺流程如下: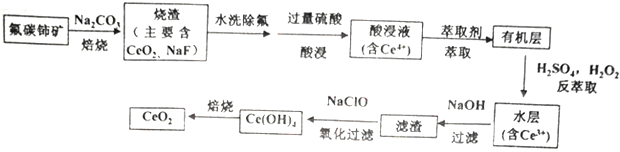
已知:①Ce4+能与SO42-结合成[CeSO4]2+;
②在硫酸体系中Ce4+能被萃取剂[(HA)2 ]萃取,而Ce3+不能。
(1)、焙烧过程中发生的主要反应方程式为。(2)、“萃取”时存在反应:Ce4+ +n(HA)2 Ce·(H2n-4A2n)+4H+。①实验室中萃取时用到的主要玻璃仪器为烧杯和。
②如图,D是分配比,表示Ce(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比(
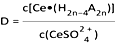 )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)变化的原因:。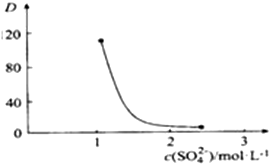
③在D=80的条件下,取20mL含四价铈总浓度为0. 1mol/L的酸浸液,向其中加入10mL萃取剂(HA)2 , 充分振荡,静置,水层中c(CeSO42+)=。 (结果保留三位有效数字)
(3)、“反萃取”中,在稀硫酸和H2O2的作用下CeO2转化为Ce3+。H2O2在该反应中作用与下列反应中H2O2的作用相同的是____________。A、H2O2和MnO2混合制O2 B、用H2O2处理含酸性K2Cr2O7的废水 C、H2O2和CaO混合制备CaO2 D、用稀硫酸和H2O2的混合液溶解金属Cu(4)、溶液中c(Ce3+)等于1.0×10-5mol·L-1 , 可认为Ce3+沉淀完全,此时溶液的pH为 , (已知298K时,Ksp[Ce(OH)3]=1.0×10-20);“氧化过滤”步骤中氧化过程的离子方程式为 。(5)、取上述流程中得到的CeO2产品m g,加硫酸溶解后,加入V1mL a mol/L FeSO4溶液(足量),使铈被还原为Ce3+ (其它杂质均不反应,Ce3+为无色),用bmol/L的标准酸性KMnO4溶液去滴定过量的FeSO4 , 消耗标准溶液V2mL,则该产品中CeO2的质量分数为 %;下列选项可能使测定结果偏低的是。A.滴定前平视读数,滴定终点时仰视读数
B.滴定时锥形瓶内溶液变红就立即停止滴定
C.滴定管尖嘴部分滴定前无气泡,滴定终点有气泡
10. B元素和N元素对植物生长及人体健康有着十分重要的作用,也广泛应用于新型材料的制备。(1)、基态氮原子的外围电子排布图为;晶体硼单质的基本结构单元为正二十面体,其能自发地呈现多面体外形,这种性质称为晶体的性。(2)、氨硼烷(NH3BH3)被认为是最具潜力的新型储氢材料之一,与氨硼烷互为等电子体的分子、离子的化学式分别是、。 (各举一例),第二周期元素中第一电离能介于B和N之间的元素是(填元素符号)。(3)、血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡咯和血红素的结构如下图: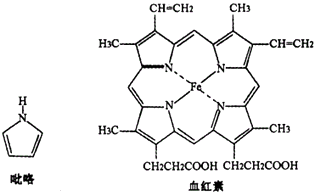
①已知吡咯中的各个原子均在同一平面内;则吡咯分子中N原子的杂化类型为。
②1mol吡咯分子中所含的σ键总数为个;分子中的大π键可用Π 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡咯环中的大π键应表示为。
③C、N、O三种元素的简单氢化物键角由小到大的顺序为(填化学式),原因是。
④血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过键相结合。
(4)、氮化硼(BN)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,晶胞结构如图所示。已知该晶体密度为ag/cm3 , 根据硬球接触模型计算晶体中两个最近的N原子间的距离为:pm。(用含a的代数式表示,NA表示阿伏加德罗常数)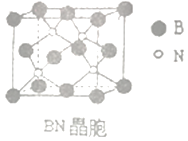 11. PVAc是一种具有热塑性的树脂,可合成重要高分子材料M,合成路线如下:
11. PVAc是一种具有热塑性的树脂,可合成重要高分子材料M,合成路线如下: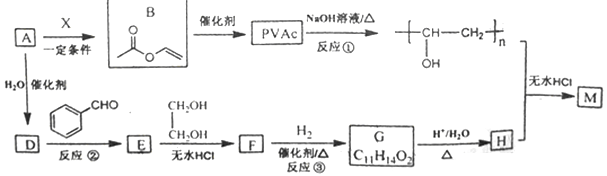
已知:R、R1、R2为H原子或烃基
Ⅰ.
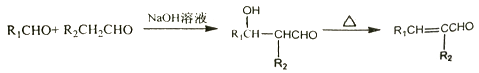
Ⅱ.
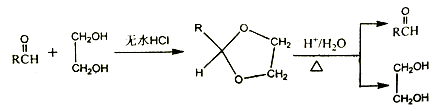
Ⅲ.羟基连在碳碳双键或碳碳三键上不稳定。
(1)、已知标准状况下,4.48L气态烃A的质量是5.2g,A→B为加成反应,则X的结构简式为;B中官能团的名称是。(2)、E能使溴的四氯化碳溶液褪色,反应②的反应试剂和条件是 , 在E→F→G→H的转化过程中,乙二醇的作用是。(3)、反应①的化学方程式为。(4)、已知M的链节中除苯环外,还含有六元环状结构,则M的结构简式为。(5)、E的同分异构体中含有苯环和甲基,且甲基不与苯环直接相连的同分异构体有种。(6)、以甲醛、苯乙醛(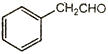 )以及上述合成路线中的必要有机试剂为原料合成
)以及上述合成路线中的必要有机试剂为原料合成 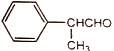 (其他无机试剂任选),请写出合成路线。
(其他无机试剂任选),请写出合成路线。