2018年高考理综化学真题试卷(全国Ⅱ卷)
试卷更新日期:2018-06-12 类型:高考真卷
一、选择题
-
1. 化学与生活密切相关,下列说法错误的是()A、碳酸钠可用于去除餐具的油污 B、漂白粉可用于生活用水的消毒 C、氢氧化铝可用于中和过多的胃酸 D、碳酸钡可用于胃肠X射线造影检查2. 研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是()
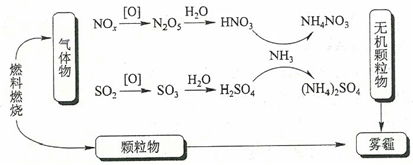
A、雾和霾的分散剂相同 B、雾霾中含有硝酸铵和硫酸铵 C、NH3是形成无机颗粒物的催化剂 D、雾霾的形成与过度施用氮肥有关3. 实验室用如图所示的装置进行甲烷与氯气在光照下反应的实验。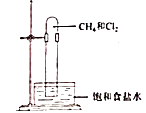
光照下反应一段时间后,下列装置示意图中能正确反应实验现象的是()A、 B、
B、 C、
C、 D、
D、 4. W、X、Y和Z为原子序数一次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同,下列叙述正确的是()A、X与其他三种元素均可形成两种或两种以上的二元化合物 B、Y与其他三种元素分别形成的化合物中只含有离子键 C、四种元素的简单离子具有相同的电子层结构 D、W的氧化物对应的水化物均为强酸5. NA代表阿伏加德罗常数的值,下列说法正确的是()A、常温常压下,124g P4中所含P-P键数目为4NA B、100mL 1mol·L-1 FeCl3溶液中所含Fe3+的数目为0.1NA C、标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA D、密闭容器中,2mol SO2 和1mol O2催化反应后分子总数为2NA6. 我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池,将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na 2Na2CO3+C,下列说法错误的是()
4. W、X、Y和Z为原子序数一次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同,下列叙述正确的是()A、X与其他三种元素均可形成两种或两种以上的二元化合物 B、Y与其他三种元素分别形成的化合物中只含有离子键 C、四种元素的简单离子具有相同的电子层结构 D、W的氧化物对应的水化物均为强酸5. NA代表阿伏加德罗常数的值,下列说法正确的是()A、常温常压下,124g P4中所含P-P键数目为4NA B、100mL 1mol·L-1 FeCl3溶液中所含Fe3+的数目为0.1NA C、标准状况下,11.2L甲烷和乙烯混合物中含氢原子数目为2NA D、密闭容器中,2mol SO2 和1mol O2催化反应后分子总数为2NA6. 我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池,将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na 2Na2CO3+C,下列说法错误的是()
 A、放电时,ClO4-向负极移动 B、充电时释放CO2 , 放电时吸收CO2 C、放电时,正极反应为:3CO2+4e-=2CO32-+C D、充电时,正极反应为:Na+ + e- =Na7. 下列实验过程可以达到实验目的的是( )
A、放电时,ClO4-向负极移动 B、充电时释放CO2 , 放电时吸收CO2 C、放电时,正极反应为:3CO2+4e-=2CO32-+C D、充电时,正极反应为:Na+ + e- =Na7. 下列实验过程可以达到实验目的的是( )编号 实验目的 实验过程 A 配制0.4000mol.L-1的溶液 称取4.0g固体NaOH于烧杯中,加入少量蒸馏水溶解,转移至250mL容量瓶中定容 B 探究维生素C的还原性 向盛有2mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 C 制取并纯化氢气 向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液 D 探究浓度对反应速率的影响 向2支盛有5mL不同浓度NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象 A、A B、B C、C D、D二、非选择题
-
8. 我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有 和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
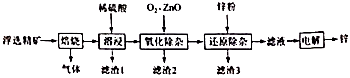
相关金属离子 形成氢氧化物沉淀的pH范围如下:
回答下列问题:金属离子 开始沉淀的pH 1.5 6.3 6.2 7.4 沉淀完全的pH 2.8 8.3 8.2 9.4 (1)、焙烧过程中主要反应的化学方程式为。(2)、滤渣1的主要成分出 外还有;氧化除杂工序中ZnO的作用是.若不通入氧气,其后果是。(3)、溶液中的 可用锌粉除去,还原除杂工序中反应的离子方程式为。(4)、电解硫酸锌溶液制备单质锌时,阴极的电极反应式为;沉积锌后的电解液可返回工序继续使用。9. 催化重整不仅可以得到合成气(CO和 )。还对温室气体的减排具有重要意义。回答下列问题:(1)、 催化重整反应为: 。已知:
该催化重整反应的 。有利于提高 平衡转化率的条件是(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2L的容器中加入 以及催化剂进行重整反应。达到平衡时 的转化率是50%,其平衡常数为 。
(2)、反中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:积碳反应
消碳反应
75
172
活化能/
催化剂X
33
91
催化剂Y
43
72
①由上表判断,催化剂XY(填“优于或劣于”),理由是.在反应进料气组成,压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如右图所示,升高温度时,下列关于积碳反应,消碳反应的平衡常数(K)和速率(v)的叙述正确的是(填标号)
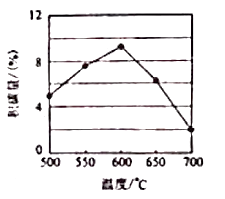
A.K积、K消均增加
B.V积减小、V消增加
C.K积减小、K消增加
D.v消增加的倍数比v积增加的倍数大
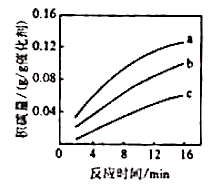
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为 (k为速率常数)。在 一定时,不同 下积碳量随时间的变化趋势如右图所示,则Pa(CO2)、Pb(CO2)、Pc(CO2)从大到小的顺序为
 10. (三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图,回答下列问题:(1)、晒制蓝图时,用 作感光剂,以K3[Fe(CN6)]溶液为显色剂.其光解反应的化学方程式为 ,显色反应的化学方程式为.
10. (三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图,回答下列问题:(1)、晒制蓝图时,用 作感光剂,以K3[Fe(CN6)]溶液为显色剂.其光解反应的化学方程式为 ,显色反应的化学方程式为.
(2)、某小组为探究三草酸合铁酸钾的热分解产物,按下面所示装置进行实验。
①通入氮气的目的是。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中一定含有、。
③为防止倒吸,停止实验时应进行的操作是。
④样品完全分解后,装置A中的残留物含有 和 ,检验 存在的方法是:。
(3)、测定三草酸合铁酸钾中铁的含量。①称量 样品于锥形瓶中,溶解后加稀 酸化,用 溶液滴定至终点。滴定终点的现象是。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中,加稀 酸化,用 溶液滴定至终点,消耗 溶液 ,该晶体中铁的质量分数的表达式为。
三、选考题[化学——选修3:物质结构与性质]
-
11. 硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S
S
FeS2
SO2
SO3
H2SO4
熔点/℃
-85.5
115.2
>600(分解)
-75.5
16.8
10.3
沸点/℃
-60.3
444.6
-10.0
45.0
337.0
回答下列问题:
(1)、基态Fe原子价层电子的电子排布图(轨道表达式)为 , 基态S原子电子占据最高能级的电子云轮廓图为 形。(2)、根据价层电子对互斥理论,H2S,SO2 , SO3的气态分子中,中心原子价层电子对数不同于其他分子的是。(3)、图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为。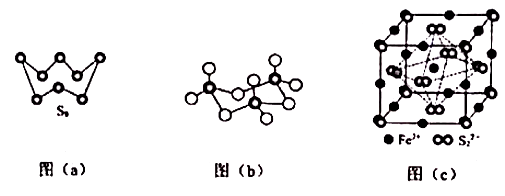 (4)、气态三氧化硫以单分子形式存在,其分子的立体构型为形,其中共价键的类型有种;固体三氧化硫中存在如图(b)所示的三氯分子。该分子中S原子的杂化轨道类型为。(5)、FeS2晶体的晶胞如图(c)所示,晶胞边长为a nm,FeS2相对式量为M、阿伏加德罗常数的值为NA , 其晶体密度的计算表达式为 ;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为 nm
(4)、气态三氧化硫以单分子形式存在,其分子的立体构型为形,其中共价键的类型有种;固体三氧化硫中存在如图(b)所示的三氯分子。该分子中S原子的杂化轨道类型为。(5)、FeS2晶体的晶胞如图(c)所示,晶胞边长为a nm,FeS2相对式量为M、阿伏加德罗常数的值为NA , 其晶体密度的计算表达式为 ;晶胞中Fe2+位于S22-所形成的正八面体的体心,该正八面体的边长为 nm四、选考题[化学—选修5:有机化学基础]
-
12. 以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物。有葡萄糖为原料合成E的路线如下:
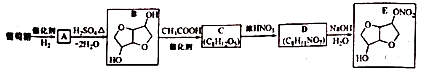
回答下列问题:
(1)、葡萄糖的分子式为.(2)、A中含有的官能团的名称为.(3)、由B到C的反应类型为.(4)、C的结构简式为.(5)、由D到E的反应方程式为.(6)、F是B的同分异构体,7.30g的F与足量饱和碳酸氢钠反应可释放出2.24L二氧化碳(标准状况),F的可能结构共有种(不考虑立体异构);其中核磁共振氢谱为三组峰,峰面积比为3:1:1的结构简式为.
-