2018年高考理综化学真题试卷(全国Ⅲ卷)
试卷更新日期:2018-06-11 类型:高考真卷
一、选择题
-
1. 化学与生活密切相关。下列说法错误的是A、泡沫灭火器可用于一般的起火,也适用于电器起火 B、疫苗一般应冷藏存放,以避免蛋白质变性 C、家庭装修时用水性漆替代传统的油性漆,有利于健康及环境 D、电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法2. 下列叙述正确的是A、24 g 镁与27 g铝中,含有相同的质子数 B、同等质量的氧气和臭氧中,电子数相同 C、1 mol重水与1 mol水中,中子数比为2∶1 D、1 mol乙烷和1 mol乙烯中,化学键数相同3. 苯乙烯是重要的化工原料。下列有关苯乙烯的说法错误的是A、与液溴混合后加入铁粉可发生取代反应 B、能使酸性高锰酸钾溶液褪色 C、与氯化氢反应可以生成氯代苯乙烯 D、在催化剂存在下可以制得聚苯乙烯4. 下列实验操作不当的是A、用稀硫酸和锌粒制取H2时,加几滴CuSO4溶液以加快反应速率 B、用标准HCl溶液滴定NaHCO3溶液来测定其浓度,选择酚酞为指示剂 C、用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有Na+ D、常压蒸馏时,加入液体的体积不超过圆底烧瓶容积的三分之二5. 一种可充电锂-空气电池如图所示。当电池放电时,O2与Li+在多孔碳材料电极处生成Li2O2-x(x=0或1)。下列说法正确的是
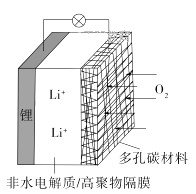 A、放电时,多孔碳材料电极为负极 B、放电时,外电路电子由多孔碳材料电极流向锂电极 C、充电时,电解质溶液中Li+向多孔碳材料区迁移 D、充电时,电池总反应为Li2O2-x=2Li+(1- )O26. 用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是
A、放电时,多孔碳材料电极为负极 B、放电时,外电路电子由多孔碳材料电极流向锂电极 C、充电时,电解质溶液中Li+向多孔碳材料区迁移 D、充电时,电池总反应为Li2O2-x=2Li+(1- )O26. 用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是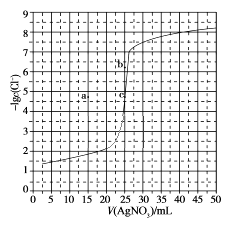 A、根据曲线数据计算可知Ksp(AgCl)的数量级为10-10 B、曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl) C、相同实验条件下,若改为0.0400 mol·L-1 Cl- , 反应终点c移到a D、相同实验条件下,若改为0.0500 mol·L-1 Br- , 反应终点c向b方向移动7. W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到YZW的溶液。下列说法正确的是A、原子半径大小为W<X<Y<Z B、X的氢化物水溶液酸性强于Z的 C、Y2W2与ZW2均含有非极性共价键 D、标准状况下W的单质状态与X的相同
A、根据曲线数据计算可知Ksp(AgCl)的数量级为10-10 B、曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl) C、相同实验条件下,若改为0.0400 mol·L-1 Cl- , 反应终点c移到a D、相同实验条件下,若改为0.0500 mol·L-1 Br- , 反应终点c向b方向移动7. W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到YZW的溶液。下列说法正确的是A、原子半径大小为W<X<Y<Z B、X的氢化物水溶液酸性强于Z的 C、Y2W2与ZW2均含有非极性共价键 D、标准状况下W的单质状态与X的相同二、非选择题
-
8. 硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol−1)可用作定影剂、还原剂。回答下列问题:(1)、已知:Ksp(BaSO4)=1.1×10−10 , Ksp(BaS2O3)=4.1×10−5。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
实验步骤
现象
①取少量样品,加入除氧蒸馏水
②固体完全溶解得无色澄清溶液
③
④ , 有刺激性气体产生
⑤静置,
⑥
(2)、利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在中溶解,完全溶解后,全部转移至100 mL的中,加蒸馏水至。
②滴定:取0.00950 mol·L−1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72−+6I−+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32−=S4O62−+2I−。加入淀粉溶液作为指示剂,继续滴定,当溶液 , 即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为%(保留1位小数)。
9. KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:(1)、KIO3的化学名称是。(2)、利用“KClO3氧化法”制备KIO3工艺流程如下图所示: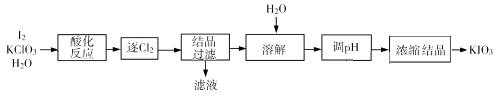
“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是。“滤液”中的溶质主要是。“调pH”中发生反应的化学方程式为。
(3)、KClO3也可采用“电解法”制备,装置如图所示。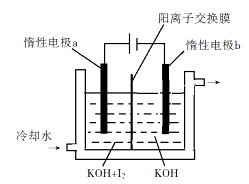
①写出电解时阴极的电极反应式。
②电解过程中通过阳离子交换膜的离子主要为 , 其迁移方向是。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有(写出一点)。
10. 三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料。回答下列问题:(1)、SiHCl3在常温常压下为易挥发的无色透明液体,遇潮气时发烟生成(HSiO)2O等,写出该反应的化学方程式。(2)、SiHCl3在催化剂作用下发生反应:2SiHCl3(g)=SiH2Cl2(g)+ SiCl4(g) ΔH1=48 kJ·mol−1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3 (g) ΔH2=−30 kJ·mol−1
则反应4SiHCl3(g)=SiH4(g)+ 3SiCl4(g)的ΔH= kJ·mol−1。
(3)、对于反应2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。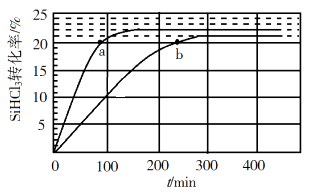
①343 K时反应的平衡转化率α=%。平衡常数K343 K=(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是;要缩短反应达到平衡的时间,可采取的措施有、。
③比较a、b处反应速率大小:vavb(填“大于”“小于”或“等于”)。反应速率v=v正−v逆= − ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处 =(保留1位小数)。
三、选考题
-
11. [化学——选修3:物质结构与性质]
锌在工业中有重要作用,也是人体必需的微量元素。回答下列问题:
(1)、Zn原子核外电子排布式为。(2)、黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Ⅰ1(Zn)Ⅰ1(Cu)(填“大于”或“小于”)。原因是。(3)、ZnF2具有较高的熔点(872 ℃),其化学键类型是;ZnF2不溶于有机溶剂而ZnCl2、ZnBr2、ZnI2能够溶于乙醇、乙醚等有机溶剂,原因是。(4)、《中华本草》等中医典籍中,记载了炉甘石(ZnCO3)入药,可用于治疗皮肤炎症或表面创伤。ZnCO3中,阴离子空间构型为 , C原子的杂化形式为。(5)、金属Zn晶体中的原子堆积方式如图所示,这种堆积方式称为。六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA , Zn的密度为g·cm-3(列出计算式)。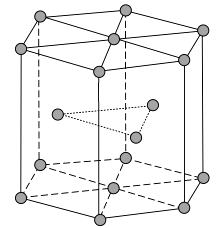
四、选考题
-
12. [化学——选修5:有机化学基础]
近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:

已知:
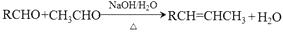
回答下列问题:
(1)、A的化学名称是。(2)、B为单氯代烃,由B生成C的化学方程式为。(3)、由A生成B、G生成H的反应类型分别是、。(4)、D的结构简式为。(5)、Y中含氧官能团的名称为。(6)、E与F在Cr-Ni催化下也可以发生偶联反应,产物的结构简式为。(7)、X与D互为同分异构体,且具有完全相同官能团。X的核磁共振氢谱显示三种不同化学环境的氢,其峰面积之比为3∶3∶2。写出3种符合上述条件的X的结构简式。
-