黑龙江省齐齐哈尔市2017-2018学年高考理综-化学三模考试试卷
试卷更新日期:2018-06-06 类型:高考模拟
一、单选题
-
1. 化学与生活密切相关。下列说法正确的是( )A、植物油的主要成分是不饱和高级脂肪酸甘油酯 B、尼龙绳、宣纸均可由合成纤维制造 C、淀粉和纤维素都是人体中能量的重要来源 D、酶是生物体内重要的催化剂,仅由碳、氢、氧三种元素组成2. 已知有机物
 是合成青蒿素的原料之一。下列有关该有机物的说法正确的是( ) A、分子式为C6H11O4 B、可与酸性KMnO4溶液反应 C、既能发生取代反应,又能发生加成反应 D、是乙酸的同系物,能和碳酸钠反应3. ClO2和NaClO2均具有漂白性,工业上由ClO2气体制取NaClO2固体的工艺流程如图所示,下列说法错误的是( )
是合成青蒿素的原料之一。下列有关该有机物的说法正确的是( ) A、分子式为C6H11O4 B、可与酸性KMnO4溶液反应 C、既能发生取代反应,又能发生加成反应 D、是乙酸的同系物,能和碳酸钠反应3. ClO2和NaClO2均具有漂白性,工业上由ClO2气体制取NaClO2固体的工艺流程如图所示,下列说法错误的是( )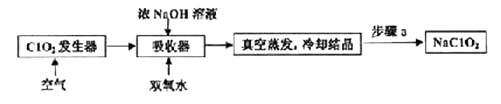 A、通入的空气可将发生器中产生的ClO2全部驱赶到吸收器中 B、吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H++O2↑ C、步骤a的操作包括过滤、洗涤和干燥 D、工业上将ClO2气体制成NaClO2固体,其主要目的是便于贮存和运输4. 阿伏加德罗常数的值为NA , 下列说法正确的是( )A、0.1molNaHSO4晶体中,含有H+的数目为0.1NA B、28g乙烯和丙烯(CH2=CHCH3)混合气体中含共价单键的数目为4NA C、1L 0.1mol/L的Na2CO3溶液中CO32-和HCO3-离子数目之和为0.1NA D、质量均为22g的T2O与D218O中所含中子数均为12NA5. a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与电子层数相同,b的最高和最低化合价的代数和为0,c的最高价氧化物对应的水化物为强碱,d与b同族。下列叙述错误的是( )A、原子半径:a<b<d<c B、c的单质在着火时不能用水灭火 C、向d的含氧酸钠盐溶液中通入b的最高价氧化物,有白色沉淀析出 D、a、b形成的化合物一定能使溴的四氯化碳溶液褪色6. 用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。下列说法正确的是( )
A、通入的空气可将发生器中产生的ClO2全部驱赶到吸收器中 B、吸收器中生成NaClO2的离子方程式为2ClO2+H2O2=2ClO2-+2H++O2↑ C、步骤a的操作包括过滤、洗涤和干燥 D、工业上将ClO2气体制成NaClO2固体,其主要目的是便于贮存和运输4. 阿伏加德罗常数的值为NA , 下列说法正确的是( )A、0.1molNaHSO4晶体中,含有H+的数目为0.1NA B、28g乙烯和丙烯(CH2=CHCH3)混合气体中含共价单键的数目为4NA C、1L 0.1mol/L的Na2CO3溶液中CO32-和HCO3-离子数目之和为0.1NA D、质量均为22g的T2O与D218O中所含中子数均为12NA5. a、b、c、d为原子序数依次增大的短周期主族元素,a原子核外电子总数与电子层数相同,b的最高和最低化合价的代数和为0,c的最高价氧化物对应的水化物为强碱,d与b同族。下列叙述错误的是( )A、原子半径:a<b<d<c B、c的单质在着火时不能用水灭火 C、向d的含氧酸钠盐溶液中通入b的最高价氧化物,有白色沉淀析出 D、a、b形成的化合物一定能使溴的四氯化碳溶液褪色6. 用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示,质子膜允许H+和H2O通过。下列说法正确的是( ) A、电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2↑ B、电解时H+由电极I向电极II迁移 C、吸收塔中的反应为2NO+2S2O42-+2H2O=N2+4HSO3- D、每处理1molNO,可同时得到32gO27. 常温下用0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000mol/L的三种一元碱XOH、MOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示。下列叙述错误的是( )
A、电极I为阴极,电极反应式为2H2O+2e-=2OH-+H2↑ B、电解时H+由电极I向电极II迁移 C、吸收塔中的反应为2NO+2S2O42-+2H2O=N2+4HSO3- D、每处理1molNO,可同时得到32gO27. 常温下用0.1000mol/L的盐酸分别逐滴加入到20.00mL0.1000mol/L的三种一元碱XOH、MOH、YOH溶液中,溶液的pH随加入盐酸体积的变化如图所示。下列叙述错误的是( ) A、XOH为强碱,MOH、YOH均为弱碱 B、V[HCl(aq)]=15.00mL时,三种溶液中离子总浓度大小顺序:XOH>MOH>YOH C、V[HCl(aq)]=20.00mL时,三种溶液中水的电离程度:XOH>MOH>YOH D、V[HCl(aq)]=40.00mL.时,YOH溶液中:c(H+)=c(Y+)+c(OH-)+2c(YOH)
A、XOH为强碱,MOH、YOH均为弱碱 B、V[HCl(aq)]=15.00mL时,三种溶液中离子总浓度大小顺序:XOH>MOH>YOH C、V[HCl(aq)]=20.00mL时,三种溶液中水的电离程度:XOH>MOH>YOH D、V[HCl(aq)]=40.00mL.时,YOH溶液中:c(H+)=c(Y+)+c(OH-)+2c(YOH)二、实验题
-
8. 实验室用图1所示装置制备KClO溶液,并通过KClO溶液与FeCl3 溶液的反应制备高效水处理剂K2FeO4。
已知K2FeO4具有下列性质: ①可溶于水,微溶于饱和KOH溶液;②在0~5 ℃的强碱性溶液中比较稳定;③在Fe3+和Fe(OH)3催化作用下发生分解;④在酸性至弱碱性条件下,能与水反应生成Fe(OH)3和O2。

回答下列问题:
(1)、装置A用于产生氯气,若选用图2中的甲装置,反应的离子方程式是 , 若选用装置乙,其中的导管a的作用是。(2)、Cl2与KOH 在较高温度下反应生成KClO3。在不改变KOH溶液的浓度和体积的条件下,控制反应在0~5℃进行。实验中可采取的措施是;在通入氯气的过程中,不断搅拌的目的是。(3)、制备K2FeO4时,KClO饱和溶液与FeCl3饱和溶液的混合方式为 , 反应的离子方程式是。(4)、提纯K2FeO4粗产品[ 含有Fe(OH)3、KCl等杂质]的实验方案为:将K2FeO4粗产品溶于冷的3 mol/LKOH 溶液中(填操作名称),将滤液置于冰水浴中,再加入 , 搅拌、静置、再过滤,晶体用适量乙醇洗涤2~3次后,在真空干燥箱中干燥。三、填空题
-
9. 氢气的制取与储存是氢能源利用领域的研究热点。回答下列问题:(1)、直接热分解法制氢
某温度下,2H2O(g) 2H2(g) +O2(g),该反应的平衡常数表达式为K=。
(2)、乙醇水蒸气重整制氢反应过程和反应的平衡常数(K)随温度(T)的变化曲线如图1所示。某温度下,图1所示反应每生成1mol H2(g),热量变化是62 kJ,则该反应的热化学方程式为。
 (3)、水煤气法制氢CO(g)+ H2O(g) CO2(g) +H2(g) △H<0
(3)、水煤气法制氢CO(g)+ H2O(g) CO2(g) +H2(g) △H<0在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率见图2(图中各点对应的反应温度可能相同,也可能不同)。

①向2 L恒温恒容密闭容器中加入一定量的CO和0.1mol H2O(g),在图中G点对应温度下,反应经5 min 达到平衡,则平均反应速率v(CO)=。
②图中B、E 两点对应的反应温度分别为TB和TE , 则TBTE (填“>”“ <”或“=”)。
③经分析,A、E、G三点对应的反应温度都相同(均为T℃),其原因是A、E、G 三点对应的相同。
④当T℃时,若向一容积可变的密闭容器中同时充入3.0 mol CO、1.0 mol H2O(g)、1.0 molCO2和x mol H2 , 为使上述反应开始时向正反应方向进行,则x应满足的条件是。
(4)、光电化学分解制氢反应原理如图3,钛酸锶光电极的电极反应式为4OH--4e-=O2↑+2H2O,则铂电极的电极反应式为。
 (5)、Mg2Cu 是一种储氢合金。350℃时,Mg2Cu 与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数约为7.7%)。该反应的化学方程式为。10. 砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:(1)、Ga基态原子核外电子排布式为 , As基态原子核外有个未成对电子。(2)、Ga、As、Se的第一电离能由大到小的顺序是 , Ga、As、Se 的电负性由大到小的顺序是。(3)、比较下列镓的卤化物的熔点和佛点,分析其变化规律及原因:。
(5)、Mg2Cu 是一种储氢合金。350℃时,Mg2Cu 与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数约为7.7%)。该反应的化学方程式为。10. 砷化镓是继硅之后研究最深入、应用最广泛的半导体材料。回答下列问题:(1)、Ga基态原子核外电子排布式为 , As基态原子核外有个未成对电子。(2)、Ga、As、Se的第一电离能由大到小的顺序是 , Ga、As、Se 的电负性由大到小的顺序是。(3)、比较下列镓的卤化物的熔点和佛点,分析其变化规律及原因:。镓的卤化物
GaI3
GaBr3
GaCl3
熔点/℃
77.75
122.3
211.5
沸点/℃
201.2
279
346
GaF3的熔点超过1000 ℃,可能的原因是。
(4)、二水合草酸镓的结构如图1所示,其中镓原子的配位数为 , 草酸根中碳原子的杂化轨道类型为。 (5)、砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为g/ cm3(设NA为阿伏加德罗常数的值,列出计算式即可)。
(5)、砷化镓的立方晶胞结构如图2所示,晶胞参数为a=0.565nm,砷化镓晶体的密度为g/ cm3(设NA为阿伏加德罗常数的值,列出计算式即可)。四、综合题
-
11. 某工业废料中含有Cr(OH)3、Al2O3、CuO、NiO等物质,工业上通过下列流程回收其中有用的金属和制取Na2Cr2O7。

已知:
①“水浸过滤”后的溶液中存在Na2CrO4、NaAlO2等物
②除去滤渣II后,溶液中存在反应2CrO42- +2H+ Cr2O72-+ H2O
③Na2Cr2O7、Na2CrO4在不同温度下的溶解度(g/100 g H2O)如下表:
 (1)、“焙烧”过程中生成NaAlO2的化学方程式为。(2)、生成滤渣时,需加入适量稀硫酸调节溶液的pH除去AlO2- , 若稀硫酸过量,则因过量引起反应的离子方程式为。(3)、“系列操作”为:继续加入稀硫酸、、冷却结晶、过滤。继续加入稀硫酸的目的是;滤渣III中除含有少量硫酸钠晶体外,主要成分是 (写化学式)。(4)、工业上还可以在“水浸过滤”后的溶液中加入适量稀硫酸,用石墨作电极电解生产金属铬,阴极的电极反应式为。(5)、流程图最后的“滤液”中仍然有残留的Na2Cr2O7。Cr 为重金属元素,若含量过高就排入河流中,会对河水造成重金属污染。为测定“滤液”中的c(Na2Cr2O7),某实验小组取“滤液”20 mL,加水稀釋至250 mL,再取稀释后的溶液25 mL于锥形瓶中,用c mol/L'的FeSO4溶液进行氧化还原滴定,到终点时清耗FeSO4溶液体积为V mL[已知发生的反应为Na2Cr2O7+FeSO4+H2SO4→Na2SO4+Cr2(SO4)3+ Fe2(SO4)3+ H2O(未配平)],则“滤液”中的c(Na2Cr2O7)=mol/L。
(1)、“焙烧”过程中生成NaAlO2的化学方程式为。(2)、生成滤渣时,需加入适量稀硫酸调节溶液的pH除去AlO2- , 若稀硫酸过量,则因过量引起反应的离子方程式为。(3)、“系列操作”为:继续加入稀硫酸、、冷却结晶、过滤。继续加入稀硫酸的目的是;滤渣III中除含有少量硫酸钠晶体外,主要成分是 (写化学式)。(4)、工业上还可以在“水浸过滤”后的溶液中加入适量稀硫酸,用石墨作电极电解生产金属铬,阴极的电极反应式为。(5)、流程图最后的“滤液”中仍然有残留的Na2Cr2O7。Cr 为重金属元素,若含量过高就排入河流中,会对河水造成重金属污染。为测定“滤液”中的c(Na2Cr2O7),某实验小组取“滤液”20 mL,加水稀釋至250 mL,再取稀释后的溶液25 mL于锥形瓶中,用c mol/L'的FeSO4溶液进行氧化还原滴定,到终点时清耗FeSO4溶液体积为V mL[已知发生的反应为Na2Cr2O7+FeSO4+H2SO4→Na2SO4+Cr2(SO4)3+ Fe2(SO4)3+ H2O(未配平)],则“滤液”中的c(Na2Cr2O7)=mol/L。五、推断题
-
12. 药物W对肝癌的治疗具有很好的效果,一种合成药物W的路线如下:

已知以下信息:
①2HCHO +NaOH→CH3OH+ HCOONa
②

③丁烯二酸酐的结构筒式为

回答下列问题:
(1)、有机物A中含有的官能团有碳碳双键、(填名称)。(2)、第①步反应中除生成 外,还生成另一产物,此产物的结构简式为。 (3)、H 的结构简式为。(4)、第⑤步的反应类型是。(5)、L是药物W的同分异构体,同时满足下列条件的L有种(不考虑立体异构);
外,还生成另一产物,此产物的结构简式为。 (3)、H 的结构简式为。(4)、第⑤步的反应类型是。(5)、L是药物W的同分异构体,同时满足下列条件的L有种(不考虑立体异构);①分子中含有苯环,苯环上有4 个取代基
②既能与FeCl3溶液发生显色反应,又能与NaHCO3溶液反应生成气体
③1mol L能与3 mol NaOH 完全反应
其中核磁共振氢谱为四组峰,峰面积比为1:2:2:3 的结构简式为。
(6)、写出由 制备丁烯二酸酐
制备丁烯二酸酐  的合成路线:(其他试剂任选)。
的合成路线:(其他试剂任选)。
-
-