河南省郑州市2017-2018学年高考理综-化学三模考试试卷
试卷更新日期:2018-06-06 类型:高考模拟
一、单选题
-
1. 化学与生活密切相关。下列分析错误的是( )A、“煮豆燃豆萁,豆在釜中泣”,句中涉及的的能量变化主要是化学能转化为热能和光能 B、食品添加剂可以改善食品品质及延长食品保存期,在添加时无需对其用量进行严格控制 C、“一带一路”是“丝绸之路经济带”和“21世纪海上丝绸之路”的简称。丝绸的主要成分是蛋白质 D、绿色化学是指在化学产品的设计、开发和加工生产过程中减少使用或产生对环境有害物质的科学2. 设NA为阿伏加德罗常数的值,下列叙述正确的是( )A、常温下,2.7g铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA B、标准状况下,2.24LSO3中所含原子数为0.4 NA C、常温常压下,16gO2和O3的混合气体中所含原子数目为NA D、在一定条件下1molN2与3molH2反应生成的NH3分子数为2NA3. 化合物W(
 )、M(
)、M(  )、N(
)、N(  )的分子式均为C7H8。下列说法正确的是( ) A、W、M、N均能与溴水发生加成反应 B、W、M、N的一氯代物数目相等 C、W、M、N分子中的碳原子均共面 D、W、M、N均能使酸性KMnO4溶液褪色4. 短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子半径小于Y的原子半径,Z的单质是空气中含量最高的气体,W原子最外层比Y原子最外层少1个电子,W的单质制得的金属容器常温下可盛装浓硫酸。下列说法正确的是( )A、Y与X可以分别形成原子个数比为1:1、1:2、1:3、1:4的化合物 B、最高价氧化物对应的水化物酸性:Y>Z>W C、原子半径:X<Y<Z<W D、简单离子半径:W>Z5. 全钒液流电池充电时间短,续航能力强,其充放电原理为VO2++V3++H2O VO2++V2++2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4示意图如下。下列说法错误的是( )
)的分子式均为C7H8。下列说法正确的是( ) A、W、M、N均能与溴水发生加成反应 B、W、M、N的一氯代物数目相等 C、W、M、N分子中的碳原子均共面 D、W、M、N均能使酸性KMnO4溶液褪色4. 短周期主族元素X、Y、Z、W的原子序数依次增大,X的原子半径小于Y的原子半径,Z的单质是空气中含量最高的气体,W原子最外层比Y原子最外层少1个电子,W的单质制得的金属容器常温下可盛装浓硫酸。下列说法正确的是( )A、Y与X可以分别形成原子个数比为1:1、1:2、1:3、1:4的化合物 B、最高价氧化物对应的水化物酸性:Y>Z>W C、原子半径:X<Y<Z<W D、简单离子半径:W>Z5. 全钒液流电池充电时间短,续航能力强,其充放电原理为VO2++V3++H2O VO2++V2++2H+。以此电池为电源,用石墨电极电解Na2SO3溶液,可得到NaOH和H2SO4示意图如下。下列说法错误的是( )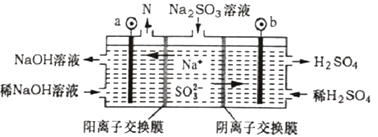 A、全钒液流电池放电时,正极的电极反应式为VO2++2H++e-=VO2++H2O B、图中a电极为阴极,N物质是H2 C、全钒液流电池充电时,V3+被氧化为VO2+ D、电解时,b电极的反应式为SO32-+H2O-2e-=SO42-+2H+6. 25℃时,向浓度均为0.1mol/L、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中lg 随n(NaOH)的变化如下图所示。下列说法错误的是( )
A、全钒液流电池放电时,正极的电极反应式为VO2++2H++e-=VO2++H2O B、图中a电极为阴极,N物质是H2 C、全钒液流电池充电时,V3+被氧化为VO2+ D、电解时,b电极的反应式为SO32-+H2O-2e-=SO42-+2H+6. 25℃时,向浓度均为0.1mol/L、体积均为100mL的两种一元酸HX、HY溶液中分别加入NaOH固体,溶液中lg 随n(NaOH)的变化如下图所示。下列说法错误的是( ) A、HX为强酸,HY为弱酸 B、b点时溶液呈中性 C、水的电离程度:d>c D、c点时溶液的pH=47. 氧化铅(PbO)是黄色固体。实验室用草酸在浓硫酸作用下分解制备CO,其原理为H2C2O4 CO↑+CO2↑+H2O。某学习小组设计实验探究CO还原氧化铅并检验氧化产物的装置如图所示(已知CO通入银氨溶液产生黑色银粒)。下列说法正确的是( )
A、HX为强酸,HY为弱酸 B、b点时溶液呈中性 C、水的电离程度:d>c D、c点时溶液的pH=47. 氧化铅(PbO)是黄色固体。实验室用草酸在浓硫酸作用下分解制备CO,其原理为H2C2O4 CO↑+CO2↑+H2O。某学习小组设计实验探究CO还原氧化铅并检验氧化产物的装置如图所示(已知CO通入银氨溶液产生黑色银粒)。下列说法正确的是( )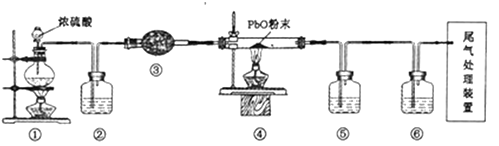 A、装置②③⑤⑥中的试剂依次为氢氧化钠溶液、碱石灰、银氨溶液、澄清石灰水 B、实验时,先点燃①处酒精灯,等装置⑥中有明显现象且有连续气泡后再点燃④处酒精灯 C、实验完毕时,先熄灭①处酒精灯,再熄灭④处酒精灯 D、尾气处理装置可选用盛NaOH溶液的洗气瓶
A、装置②③⑤⑥中的试剂依次为氢氧化钠溶液、碱石灰、银氨溶液、澄清石灰水 B、实验时,先点燃①处酒精灯,等装置⑥中有明显现象且有连续气泡后再点燃④处酒精灯 C、实验完毕时,先熄灭①处酒精灯,再熄灭④处酒精灯 D、尾气处理装置可选用盛NaOH溶液的洗气瓶二、综合题
-
8. CoCO3可用作选矿剂、催化剂及伪装涂料的颜料。以含钴废渣(主要成CoO、Co2O3 , 还含有Al2O3、ZnO 等杂质) 为原料制备CoCO3的一种工艺流程如下:

下表是相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH 按金属离子浓度为1.0mol·L-1计算):
金属离子
开始沉淀的pH
沉淀完全的pH
Co2+
7.6
9.4
Al3+
3.0
5.0
Zn2+
5.4
8.0
(1)、写出“酸溶”时发生氧化还原反应的化学方程式。(2)、“除铝”过程中需要调节溶液pH 的范围为 , 形成沉渣时发生反应的离子方程式为。(3)、在实验室里,萃取操作用到的玻璃仪器主要有;上述“萃取”过程可表示为ZnSO4(水层)+2HX(有机层) ZnX2(有机层)+H2SO4(水层),由有机层获取ZnSO4溶液的操作是。(4)、“沉钴”时,Na2CO3溶液滴加过快会导致产品不纯,请解释原因。(5)、在空气中煅烧CoCO3生成钴氧化物和CO2 , 测得充分煅烧后固体质量为2.41g,CO2 的体积为0.672 L(标准状况),则该钴氧化物的化学式为。9. 元素及其化合物在化工、医药、材料等领域有着广泛的应用,回答下列问题:(1)、参照下图B、F元素的位置,依据第二周期元素第一电离能的变化规律,用小黑点标出C、N、O 三种元素的相对位置。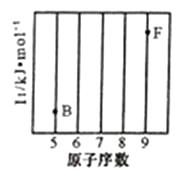 (2)、碳的一种单质的结构如图(a)所示,则碳原子的杂化轨道类型为。(3)、二卤化铅PbX2 的熔点如图(b)所示,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性( 填“增 强”、“ 不变”或“减弱”, 下 同 ), 共价性。
(2)、碳的一种单质的结构如图(a)所示,则碳原子的杂化轨道类型为。(3)、二卤化铅PbX2 的熔点如图(b)所示,可推断:依F、Cl、Br、I次序,PbX2中的化学键的离子性( 填“增 强”、“ 不变”或“减弱”, 下 同 ), 共价性。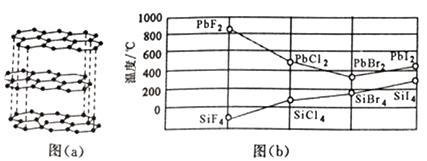 (4)、NH3和F2 在Cu催化下可发生反应4NH3+3F2 NF3+3NH4F,化学方程式中的5种物质所属的晶体类型有 (填序号)。写出基态铜原子的价电子排布式。
(4)、NH3和F2 在Cu催化下可发生反应4NH3+3F2 NF3+3NH4F,化学方程式中的5种物质所属的晶体类型有 (填序号)。写出基态铜原子的价电子排布式。a.离子晶体
b.分子晶体
c.原子晶体
d.金属晶体
(5)、BF3与一定量水形成(H2O)2·BF3晶体Q,Q在一定条件下可转化为R:
晶体R 中含有的化学键包括。
(6)、水杨酸第一级电离形成离子 ,相同温度下,水杨酸的Ka2苯酚(
,相同温度下,水杨酸的Ka2苯酚(  )的Ka(填“>”“ =”或“<”),其原因是。 (7)、碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示,K位于立方体的棱上和立方体的内部,此化合物的化学式为;其晶胞参数为1.4 nm,阿伏加德罗常数用NA表示,则晶体的密度为g·cm-3。(只需列出式子)
)的Ka(填“>”“ =”或“<”),其原因是。 (7)、碳的另一种单质C60可以与钾形成低温超导化合物,晶体结构如图(c)所示,K位于立方体的棱上和立方体的内部,此化合物的化学式为;其晶胞参数为1.4 nm,阿伏加德罗常数用NA表示,则晶体的密度为g·cm-3。(只需列出式子) 10. 白花丹酸具有镇咳祛痰的作用,其合成路线流程图如下:
10. 白花丹酸具有镇咳祛痰的作用,其合成路线流程图如下: (1)、写出B中含氧官能团的名称。(2)、写出A→B的化学方程式 。(3)、C的分子式为。C→D、E→F的反应类型分别为和。(4)、白花丹酸分子中混有
(1)、写出B中含氧官能团的名称。(2)、写出A→B的化学方程式 。(3)、C的分子式为。C→D、E→F的反应类型分别为和。(4)、白花丹酸分子中混有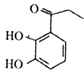 ,写出同时满足下列条件的该有机物的一种同分异构体的结构简式。
,写出同时满足下列条件的该有机物的一种同分异构体的结构简式。①分子中有四种不同化学环境的氢原子;②与FeCl3 溶液能发生显色反应,且1mol 该物质最多能与3 mol NaOH 反应。
(5)、某物G 是A的同分异构体,满足下列条件的G的同分异构体有种。①与三氯化铁溶液发生显色反应。 ②苯环上有两个取代基
(6)、已知: ,根据已有知识并结合相关信息写出以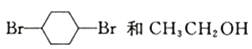 为原料制备
为原料制备  的合成路线流程图 (合成路线流程图示例参考本题题干)。
的合成路线流程图 (合成路线流程图示例参考本题题干)。 三、实验题
-
11. 为了更深刻地认识卤素的性质,某化学小组对卤素及其化合物的制备和性质进行如下探究实验,根据实验回答问题。(1)、[实验一]氯气的制取
该小组拟用下图实验装置来制备纯净、干燥的氯气,并完成与金属铁的反应(夹持仪器略去,下同)。每个虚线框表示一个单元装置,请用文字描述将下列装置的不符合题意之处改正。
 (2)、[实验二]探究氯化亚铁与氧气反应的产物
(2)、[实验二]探究氯化亚铁与氧气反应的产物已知氯化亚铁的熔点为674℃,沸点为1023℃;三氯化铁在100℃左右时升华,极易水解。在500℃条件下氯化亚铁与氧气可能发生下列反应,12FeCl2+3O2 2Fe2O3+8FeCl3、4FeCl2+3O2 2Fe2O3+4Cl2 , 该化学小组选用下图部分装置(装置可以重复选用)进行氯化亚铁与氧气反应产物的探究。

实验装置的合理连接顺序为:A→→E。
(3)、假设加热装置中的完全反应,则反应后剩余固体的化学式是。请设计实验方案验证你的假设。(4)、简述将F中的固体配成溶液的操作方法。(5)、[实验三]卤素化合物之间反应实验条件控制探究在不同实验条件下KClO3可将KI 氧化为I2 或KIO3。下面是该小组设计的一组实验数据记录表(实验控制在室温下进行):
试管标号
1
2
3
4
0.20 mol· L-1KI 溶液/mL
1.0
1.0
1.0
1.0
KClO3(s)/g
0. 10
0. 10
0.10
0.10
6.0 mol· L-1 H2SO4溶液/mL
0
3.0
6.0
9.0
蒸馏水/mL
9.0
6.0
3.0
0
实验现象
①该组实验的目的是。
②2号试管反应完全后,取少量2号试管中的溶液滴加淀粉溶液后显蓝色,假设还原产物只有KCl,写出反应的离子方程式。
四、填空题
-
12. 石油产品中含有H2S及COS、CH3SH等多种有机硫,石油化工催生出多种脱硫技术。请回答下列问题:(1)、COS的电子式是。(2)、已知热化学方程式:①2H2S(g)+SO2(g)=3S(s)+2H2O(l) △H=-362 kJ·mol-1
②2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) △H2=-1172 kJ·mol-1
则H2S气体和氧气反应生成固态硫和液态水的热化学方程式为。
(3)、可以用K2CO3溶液吸收H2S,其原理为K2CO3+H2S=KHS+KHCO3 , 该反应的平衡常数为。(已知H2CO3 的Ka1=4.2×10-7 , Ka2=5.6×10-11;H2S的Ka1=5.6×10-8 , Ka2=1.2×10-15)(4)、在强酸溶液中用H2O2 可将COS氧化为硫酸,这一原理可用于COS 的脱硫。该反应反应的化学方程式为。(5)、COS的水解反应为COS(g)+H2O(g) CO2(g)+H2S(g) △H<0。某温度时,用活性α-Al2O3作催化剂,在恒容密闭容器中COS(g)的平衡转化率随不同投料比[n(H2O)/n(COS)]的转化关系如图1所示。其它条件相同时,改变反应温度,测得一定时间内COS的水解转化率如图2所示: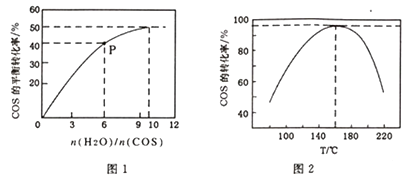
①该反应的最佳条件为:投料比[n(H2O)/n(COS)] , 温度
②P点对应的平衡常数为 。(保留小数点后2 位)
③当温度升高到一定值后,发现一定时间内COS(g)的水解转化率降低;猜测可能的原因是。
-