北京市房山区2017-2018学年高考理综-化学二模考试试卷
试卷更新日期:2018-06-06 类型:高考模拟
一、单选题
-
1. 下列中国传统工艺, 利用氧化还原反应原理实现的是( )
 A、A B、B C、C D、D2. 已知 33As 与 35Br 是位于同一周期的主族元素,下列说法正确的是( )A、原子半径: As > P > Si B、酸性: H3AsO4>H2SO4>H3PO4 C、热稳定性: HCl>AsH3>HBr D、还原性: As3->S2->Cl-3. 将下列气体通入溶有足量 SO2 的 BaCl2 溶液中, 没有沉淀产生的是( )A、NH3 B、HCl C、Cl2 D、NO24. 厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中错误的是( )
A、A B、B C、C D、D2. 已知 33As 与 35Br 是位于同一周期的主族元素,下列说法正确的是( )A、原子半径: As > P > Si B、酸性: H3AsO4>H2SO4>H3PO4 C、热稳定性: HCl>AsH3>HBr D、还原性: As3->S2->Cl-3. 将下列气体通入溶有足量 SO2 的 BaCl2 溶液中, 没有沉淀产生的是( )A、NH3 B、HCl C、Cl2 D、NO24. 厌氧氨化法(Anammox)是一种新型的氨氮去除技术,下列说法中错误的是( )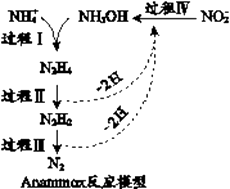 A、1mol NH4+ 所含的质子总数为10NA B、联氨(N2H4)中含有极性键和非极性键 C、过程II属于氧化反应,过程IV属于还原反应 D、过程I中,参与反应的NH4+与NH2OH的物质的量之比为1:15. 聚酯纤维以其良好的抗皱性和保形性, 较高的强度与弹性恢复能力广泛应用在服装面料及毛绒玩具的填充物中。某种无毒聚酯纤维结构如下,下列说法错误的是( )
A、1mol NH4+ 所含的质子总数为10NA B、联氨(N2H4)中含有极性键和非极性键 C、过程II属于氧化反应,过程IV属于还原反应 D、过程I中,参与反应的NH4+与NH2OH的物质的量之比为1:15. 聚酯纤维以其良好的抗皱性和保形性, 较高的强度与弹性恢复能力广泛应用在服装面料及毛绒玩具的填充物中。某种无毒聚酯纤维结构如下,下列说法错误的是( ) A、聚酯纤维一定条件下可水解 B、聚酯纤维和羊毛化学成分相同 C、该聚酯纤维单体为对苯二甲酸和乙二醇 D、由单体合成聚酯纤维的反应属于缩聚反应6. 室温下,某兴趣小组用下图装置在通风橱中进行如下实验:
A、聚酯纤维一定条件下可水解 B、聚酯纤维和羊毛化学成分相同 C、该聚酯纤维单体为对苯二甲酸和乙二醇 D、由单体合成聚酯纤维的反应属于缩聚反应6. 室温下,某兴趣小组用下图装置在通风橱中进行如下实验:
下列说法正确的是( )
A、试管 I 中浅红棕色气体为 NO2 , 由硝酸还原生成 B、等质量的 Cu 完全溶解时, I 中消耗的 HNO3 更多 C、换成 Fe 之后重复实验,依然是试管 II 中反应更剧烈 D、试管 II 中反应后溶液颜色与试管 I 中的不同, 是由于溶有 NO27. 已知: 2NO2(g)+ CH4(g) N2(g)+ CO2(g)+ 2H2O(g) ΔH,向容积为2L的恒容密闭容器中,充入NO2和CH4的混合气体0.3mol充分反应。不同投料比时,NO2的平衡转化率与温度的关系如右图所示。[投料比= ] ;下列说法错误的是( ) A、ΔH < 0 B、X > 2 C、400K时,反应的平衡常数为5×10-2 D、投料比为2时,Q点v逆(CH4)小于P点的v逆(CH4)
A、ΔH < 0 B、X > 2 C、400K时,反应的平衡常数为5×10-2 D、投料比为2时,Q点v逆(CH4)小于P点的v逆(CH4)二、综合题
-
8. 乙酰基扁桃酰氯是一种医药中间体。 某研究小组以甲苯和乙醇为主要原料,按下列路线合成乙酰基扁桃酰氯。

已知:
 (1)、甲苯与氯气反应生成 A的条件是。(2)、物质 B中含有的官能团是。(3)、物质 D 的结构简式是。(4)、下列说法正确的是。
(1)、甲苯与氯气反应生成 A的条件是。(2)、物质 B中含有的官能团是。(3)、物质 D 的结构简式是。(4)、下列说法正确的是。a.化合物 A不能发生取代反应
b.乙酰基扁桃酰氯属于芳香烃
c.化合物 C 能与新制的 Cu(OH)2发生反应
(5)、E+F→G 的化学方程式是。(6)、化合物 D 有多种同分异构体,同时符合下列条件的同分异构体共有 种,写出其中两种的同分异构体的结构简式。①红外光谱检测表明分子中含有氰基(-CN);
②1H-NMR 谱检测表明分子中有苯环,且苯环上有两种不同化学环境的氢原子。
(7)、设计以乙醇为原料制备 F 的合成路线(用流程图表示;无机试剂任选) 。9. 硫是生物必须的营养元素之一,含硫化合物在自然界中广泛存在,循环关系如下图所示: (1)、自然界地表层原生铜的硫化物经氧化、淋滤作用后变成 CuSO4溶液,向地下深层渗透遇到难溶的ZnS,慢慢转变为铜蓝( CuS), 请用化学用语表示 ZnS 转变为 CuS 的过程 。(2)、火山喷发产生 H2S 在大气当中发生如下反应:
(1)、自然界地表层原生铜的硫化物经氧化、淋滤作用后变成 CuSO4溶液,向地下深层渗透遇到难溶的ZnS,慢慢转变为铜蓝( CuS), 请用化学用语表示 ZnS 转变为 CuS 的过程 。(2)、火山喷发产生 H2S 在大气当中发生如下反应:①2H2S(g)+O2(g) =2S(g) +2H2O(g) △H=﹣442.38kJ/mol
②S(g)+O2(g)=SO2(g) △ H=﹣297.04kJ/mol。
H2S(g)与 O2(g)反应产生 SO2(g)和 H2O(g)的热化学方程式是。
(3)、降低 SO2的排放量已经写入 2018 年政府工作报告, 化石燃料燃烧时会产生含 SO2的废气进入大气,污染环境,有多种方法可用于 SO2的脱除。①NaClO 碱性溶液吸收法。工业上可用 NaClO 碱性溶液吸收 SO2。
i.反应离子方程式是。
为了提高吸收效率,常用 Ni2O3作为催化剂。在反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对 SO2的吸收。该催化过程的示意图如下图所示:

ii.过程 1 的离子方程式是。
iii.Ca(ClO)2也可用于脱硫,且脱硫效果比 NaClO 更好,原因是。
②电化学脱硫法。某种电化学脱硫法装置如下图所示,不仅可脱除烟气中的SO2还可以制得 H2SO4。

i.在阴极放电的物质是。
ii.在阳极生成 SO3的电极反应式是。
10. 某课题组以硫铁矿烧渣(含 Fe2O3、 Fe3O4、 Al2O3、 CaO、 SiO2 等)为原料制取软磁用 Fe2O3(要求纯度>99.2%, CaO 含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
已知:生成氢氧化物的 pH 如下表所示
 (1)、滤渣 A 的主要成分是。(2)、在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有。(3)、在过程Ⅱ中,课题组对滤液 A 稀释不同倍数后,加入等质量的过量铁粉,得出 Fe3+浓度、还原率和反应时间的关系如图所示:结合上述实验结果说明:课题组选择稀释后c(Fe3+)为 1.60mol/L 左右的理由是。
(1)、滤渣 A 的主要成分是。(2)、在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有。(3)、在过程Ⅱ中,课题组对滤液 A 稀释不同倍数后,加入等质量的过量铁粉,得出 Fe3+浓度、还原率和反应时间的关系如图所示:结合上述实验结果说明:课题组选择稀释后c(Fe3+)为 1.60mol/L 左右的理由是。 (4)、在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:(已知:滤液 B 中钙的含量以 CaO 计为 290—310mg/L)
(4)、在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:(已知:滤液 B 中钙的含量以 CaO 计为 290—310mg/L)沉钙剂
Na2SO3
H2C2O4
(NH4)2CO3
Na2CO3
NH4F
用量/g
2
2
2
5
2
剩余CaO/mg/L)
290
297
290
190
42
根据实验结果, 选择适宜的沉钙剂,得到滤渣 C 的主要成分有。
(5)、在过程Ⅳ中,反应温度需要控制在 35℃以下,不宜过高,其可能的原因是。(6)、在过程Ⅴ中,反应的化学方程式是。三、实验题
-
11. 某实验小组同学设计实验,完成Cu和 Fe2(SO4)3溶液的反应,用 KSCN 溶液检验是否还存在 Fe3+。
实验 I:

已知: i. Cu2+ CuSCN↓(白色) + (SCN)2(黄色)
ii. (SCN)2的性质与卤素单质相似
iii. CuSCN溶于稀硝酸,发生反应 CuSCN+HNO3==CuSO4+N2+CO2+H2O(未配平)
(1)、依据现象i可预测该反应的离子方程式为。(2)、该小组同学查阅资料认为现象ii中的白色沉淀可能为CuSCN,设计实验进行验证。实验II: 取少量实验I中的白色沉淀于试管中 , 证明该白色沉淀为CuSCN。(补充所加试剂及实验现象)
(3)、该小组同学继续探究白色沉淀的成因,进行如下实验,实验III:

在实验III中:
①写出现象i中生成白色沉淀的离子方程式。
②试剂A为。
③根据现象iii结合化学用语及必要的文字解释Fe2+能加快沉淀生成的原因。
(4)、有的同学认为实验III不能充分证明其结论,并补充实验IV如下:取2mL0.1 mol/L Fe2(SO4)3滴加3滴0.1mol/L KSCN溶液后,溶液变红,然后滴加2mL0.1mol/LCuSO4混合溶液于试管中, (现象)说明白色沉淀不是由Fe3+与SCN- 生成,且Fe3+不能加快CuSCN的生成。
(5)、改变实验I铜的用量,设计实验V
该小组同学认为实验V中现象ii红色褪去与平衡移动有关,解释为。