2018年广东省中考化学冲刺卷(四)
试卷更新日期:2018-06-04 类型:中考模拟
一、单选题
-
1. 下列各组物质的变化中,前者属于化学变化,后者属于物理变化的是( )A、冰雪融化,由空气制氧气 B、钢铁生锈,纸的燃烧 C、蜡烛燃烧,蜡烛融化 D、汽油挥发,食物腐烂2. 下列物品所使用的材料,属于有机合成材料的是( )
A、塑料杯 B、陶瓷瓦罐 C、纯棉衣物 D、羊毛衫3. 实验室存放腐蚀性药品的专柜应粘贴下列哪种标志?( )A、 B、
B、 C、
C、 D、
D、 4. 下列对部分化学知识的归纳完全正确的( )
4. 下列对部分化学知识的归纳完全正确的( )A
化学与生活:①生活中常用加热煮沸的方法软化硬水
②氧气用于医疗急救
③农业上用石灰乳和硫酸铜制波尔多液
B
化学与环境:①焚烧植物秸杆不会造成空气污染
②PM2.5是造成雾霾天气的元凶之一
③使用可降解塑料可減少“白色污染”
C
化学与安全:①皮肤沾上浓硫酸一先用水冲洗,再涂稀醋酸
②实验时碰倒酒精灯着火一用湿抹布盖灭
③冬天用煤炉取暖一保证室内通风
D
化学与健康:①人体缺铁会引起贫血症
②可用硫磺薫蒸笋干使之颜色更好看
③制作糕点过程中加入适量的碳酸氢钠,使糕点松软可口
A、A B、B C、C D、D5. 向15mLpH为5的溶液中加入等体积的下列试剂,混合液的pH肯定增大的是( )
A、氢氧化钠溶液 B、稀盐酸 C、稀硫酸 D、pH为5的溶液6. 以下是小明同学书写的部分化学用语,其中正确的是( )①金刚石﹣C ②五氧化二磷﹣O5P2 ③氯化铁﹣FeCl3 ④钠元素显+1价﹣Na+1 ⑤两个铝离子﹣2Al3+
A、①②④ B、①③⑤ C、②③⑤ D、②③④7. 下列实验设计能实现其对应的实验目的是( )A、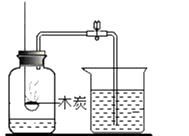 测定空气中O2的含量
B、
测定空气中O2的含量
B、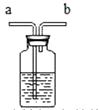 给病人输氧时a处接钢瓶
C、
给病人输氧时a处接钢瓶
C、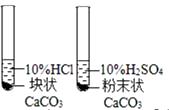 比较CaCO3与HCl及H2SO4反应速率
D、
比较CaCO3与HCl及H2SO4反应速率
D、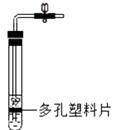 此装置具有“控制反应发生和停止”的功能
8.
此装置具有“控制反应发生和停止”的功能
8.根据如图有关信息判断,下列说法错误的是( )
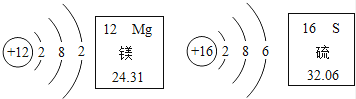 A、在元素周期表中,镁元素和硫元素属于同一周期 B、镁离子核内有12个质子 C、在化学反应中,硫原子容易失去2个电子 D、硫元素的原子序数为169. 下表列出了除去物质中所含少量杂质的方法,其中不正确的选项是( )
A、在元素周期表中,镁元素和硫元素属于同一周期 B、镁离子核内有12个质子 C、在化学反应中,硫原子容易失去2个电子 D、硫元素的原子序数为169. 下表列出了除去物质中所含少量杂质的方法,其中不正确的选项是( )选项
物质
所含杂质
除去杂质的方法
A
FeCl2溶液
CuCl2溶液
加入过量的铁粉,过滤
B
CaCO3粉末
NaCl粉末
加水溶解、过滤、洗涤、烘干
C
氯化钾
氯酸钾
加热
D
氢氧化钠溶液
氢氧化钙溶液
通入CO2 , 过滤
A、A B、B C、C D、D10.如图是a、b、c三种物质的溶解度曲线,下列分析不正确的是( )
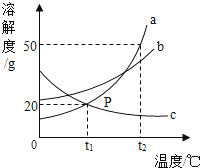 A、t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>c B、t2℃时,将50ga物质(不含结晶水)放入100g水中充分溶解得到a的饱和溶液 C、将t2℃时,a、b、c三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系是b>a=c D、将c的饱和溶液变为不饱和溶液,可采用降温的方法11. 下列实验现象描述正确的是( )A、向硫酸铜溶液中滴加氢氧化钠溶液,有白色沉淀生成 B、将二氧化碳通入紫色石蕊溶液中,溶液变蓝 C、硫在氧气中燃烧,发出蓝紫色火焰 D、打开盛有浓盐酸的试剂瓶的瓶塞,瓶口冒白烟12. Sb2O5是一种重要的阻燃剂,工业制取该物质的化学方程式为:Sb2O3+2X═Sb2O5+2H2O,则X的化学式为( )A、H2 B、O2 C、H2O2 D、H2SbO413. 某饼干包装袋上的说明(部分)如下:
A、t2℃时,a、b、c三种物质的溶解度由大到小的顺序是a>b>c B、t2℃时,将50ga物质(不含结晶水)放入100g水中充分溶解得到a的饱和溶液 C、将t2℃时,a、b、c三种物质的饱和溶液降温至t1℃,所得溶液的溶质质量分数关系是b>a=c D、将c的饱和溶液变为不饱和溶液,可采用降温的方法11. 下列实验现象描述正确的是( )A、向硫酸铜溶液中滴加氢氧化钠溶液,有白色沉淀生成 B、将二氧化碳通入紫色石蕊溶液中,溶液变蓝 C、硫在氧气中燃烧,发出蓝紫色火焰 D、打开盛有浓盐酸的试剂瓶的瓶塞,瓶口冒白烟12. Sb2O5是一种重要的阻燃剂,工业制取该物质的化学方程式为:Sb2O3+2X═Sb2O5+2H2O,则X的化学式为( )A、H2 B、O2 C、H2O2 D、H2SbO413. 某饼干包装袋上的说明(部分)如下:商品名称
XX饼干
配料
小麦粉、白砂糖、精炼植物油、鲜鸡蛋、奶油、食盐、膨松剂、食用香精
规格
400g
储藏方法
存放于阴凉干爽处,避免阳光直射
下列说法正确的是( )
A、鲜鸡蛋、奶油中富含蛋白质 B、饼干配料中只有白砂糖属于糖类 C、从营养均衡的角度看,饼干中缺乏维生素类营养素 D、饼干配料中不含无机盐14. 如图所示的四个图象,能正确反映对应变化关系的是( )A、 Ca(OH)2的溶解度与温度的变化曲线
B、
Ca(OH)2的溶解度与温度的变化曲线
B、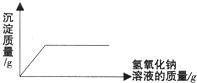 向硫酸和硫酸铜的混合溶液中逐滴加入氢氧化钠溶液
C、
向硫酸和硫酸铜的混合溶液中逐滴加入氢氧化钠溶液
C、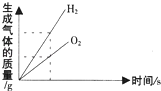 水的电解
D、
水的电解
D、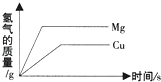 分别向等质量的镁和铜固体中逐滴加入盐酸
分别向等质量的镁和铜固体中逐滴加入盐酸
二、填空题
-
15. 请回答下列生活中的有关问题:
(1)区别棉纤维、羊毛纤维和合成纤维的最简单方法是做实验.
(2)鸡蛋中主要含有的营养物质是 (填“糖类”或“蛋白质”);能补充维生素C的食物是 .
(3)把磨好的豆浆倒在纱布袋中将渣和浆分离,相当于实验操作中的 .
16.乙醇是生产生活中常见的有机物,请根据所学知识填空:
(1)俗话说 “酒香不怕巷子深”说明分子是 ;
(2)50mL水与50mL酒精混合,所得混合物的体积小于100mL,说明分子之间是 ;
(3)下图是工业上在一定条件下制取乙醇的反应微观示意图:(“ ”代表氢原子,“
”代表氢原子,“ ”代表碳原子,“
”代表碳原子,“ ”代表氧原子)
”代表氧原子) 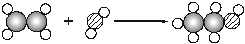
请回答:a.写出上述反应过程中的化学方程式 ;
b.该反应属于基本反应类型中的 反应。17. 化学实验中经常用到一定溶质质量分数的溶液.请回答:(1)实验室配制质量分数4%的氯化钠溶液50g.需要固体氯化钠的质量为 g,水为 mL(水的密度1g/cm3).
(2)若用质量分数为8%的氯化钠溶液配制50g质量分数为4%的氯化钠溶液.
①需要8%的氯化钠溶液的质量为 g.
②该溶液配制过程中除用到量筒、玻璃棒和胶头滴管外,还需要的仪器是 .
18.归纳总结是学习化学的一种方法.请结合小明同学对碱的四点化学性质的归纳图完成下列问题.(箭头上方的物质是指与碱反应的物质)

(1)碱溶液能使无色酚酞溶液变 .
(2)氢氧化钠暴露在空气中变质的化学方程式为 ,所以氢氧化钠必须保存.
(3)请帮小明补充完整性质3箭头上方的反应物质是(填“酸”或“碱”或“盐”).
(4)碱溶液有相似的化学性质,是因为碱溶液中都含有 (填化学符号).
19. 请回答下列与水有关的问题.(1)一壶水烧开了,壶盖被顶开,这是因为 ;
(2)硬水会给生产和生活带来许多不便,检验生活用水是否为硬水的物质是 ① ,生活中有些硬水可用 ② 的方法降低它的硬度;
(3)农业和园林浇灌植物时,将大水漫灌改为喷灌、滴灌的目的是 .
三、简答题
-
20.
绿矾又名七水硫酸亚铁(FeSO4•7H2O),其用途广泛,可用于制铁盐、氧化铁颜料、净水剂、防腐剂、消毒剂等.绿矾(FeSO4•7H2O)的一种综合利用工艺如下:
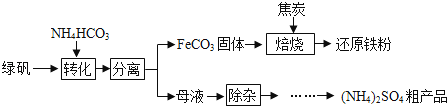
(1)细铁丝在氧气中可以燃烧,请写出铁在氧气中燃烧的化学方程式 .
(2)绿矾与NH4HCO3在溶液中反应,有CO2生成,反应的化学方程式为 .
(3)隔绝空气进行“焙烧”,铁元素的转化途径是FeCO3
 FeO
FeO Fe,实际作还原剂的是CO.写出“焙烧”过程中各步反应的化学方程式:
Fe,实际作还原剂的是CO.写出“焙烧”过程中各步反应的化学方程式:A.FeCO3
 FeO+CO2↑;
FeO+CO2↑;B. ;
C. .
(4)母液“除杂”后,欲得到(NH4)2SO4粗产品,操作步骤依次为蒸发浓缩、、过滤、洗涤、干燥.
21.A,B,C,D,E,F,G为常见的物质,A是红棕色固体,B,E,G属于单质,反应①是炼铁工业中的主要反应.如图是它们之间的相互转化关系.请回答:
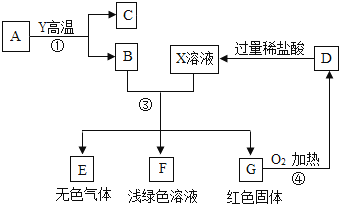
(1)写出反应①的化学方程式:
(2)写出反应③中生成G的化学方程式:
(3)如图转化中产生无色气体E的原因是22.实验室制取气体所需装置如下图所示,请回答以下问题:
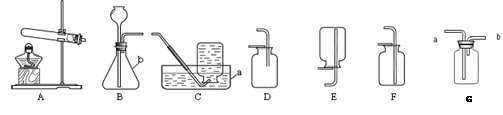
(1) 用高锰酸钾制取氧气时,所选用的发生装置是(填字母序号,下同)。用过氧化氢溶液和二氧化锰制取氧气,所选用的发生装置是 ,其化学反应方程式为。如果要制得较纯净的氧气应该选择装置 收集。
(2) 实验室选用G装置收集二氧化碳,气体应该从端进入,其验满的方法是。23. 在高温下,铁与水蒸气能发生反应生成一种常见铁的氧化物和一种气体,某学习小组的同学对此反应很感兴趣,在小组集体协作下设计了如图实验,以探究铁粉与水蒸气反应后的产物,也邀请你一起来完成下列探究: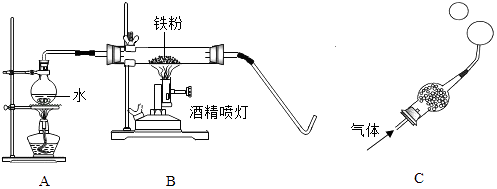
【猜想与假设】猜想一:生成的气体可能是氢气;猜想二:生成的气体可能是氧气.
【实验探究】将生成的气体通入C装置.球形管里装有碱石灰干燥剂.导管口蘸些肥皂水(或洗涤剂溶液),控制气体流速,吹出肥皂泡.当肥皂泡吹到一定大时,轻轻摆动导管,肥皂泡脱离管口后,气泡上升.用燃着的木条靠近肥皂泡,有爆鸣声.
(1)、【推断】生成的气体是 .(2)、探究试管中剩余固体成分是什么?【查阅资料】
Ⅰ.铁的氧化物①只有是Fe2O3红棕色,其余FeO、Fe3O4均为黑色;
②只有Fe3O4能被磁铁吸引.
Ⅱ.铁的氧化物都能与盐酸反应,但没有气体生成.
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引.
【猜想与假设】猜想一:剩余固体是Fe3O4;
猜想二:剩余固体是 .
(3)、【实验探究】实验操作
实验现象及结论
取少量黑色固体于试管中,加入足量
无气泡产生,黑色固体是
(4)、【实验结论】铁与水蒸气反应的化学方程式为: .(5)、【拓展延伸】Ⅰ.铁、镁混合物5.6g与足量稀硫酸反应,生成的氢气质量不可能是( )A、0.2g B、0.3g C、0.4g D、0.5g(6)、Ⅱ.某同学为探究铁合金中铁的质量分数,先后进行了四次实验(铁合金中除铁外,其余成分不与稀硫酸反应),实验数据如表.根据该同学的实验,试回答以下问题:第一次
第二次
第三次
第四次
所取合金的质量∕g
10
10
20
30
所加稀硫酸的质量∕g
100
120
80
X
生成氢气的质量∕g
0.2
0.2
0.2
Y
表中第四次实验中,合金里的铁恰好与稀硫酸完全反应,则其中X=Y= .
(7)、该铜铁合金中铁的质量分数是多少?(写出计算过程)24. 蛋白质在人体胃肠内与水反应,最终生成氨基酸被人体吸收.丙氨酸(化学式为(C3H7O2N)就是其中的一种.请回答下列问题:①丙氨酸分子中C、H、O、N各原子个数比为 .
②丙氨酸分子中C、H 元素的质量比为 .
③丙氨酸分子中 N元素的质量分数为 . (精确到0.1%)
25. 化学探究小组为测定某石灰石样品中碳酸钙的质量分数,取25g石灰石样品放在烧杯中,然后向其中逐滴加入一定量某质量分数的稀盐酸,使之与样品充分反应(杂质不参加反应).随着反应进行,加入稀盐酸的质量与反应得到气体的质量变化关系如图所示.请完成下列计算内容:(1)样品中碳酸钙的质量分数是多少?
(2)所用稀盐酸溶质的质量分数是多少?
